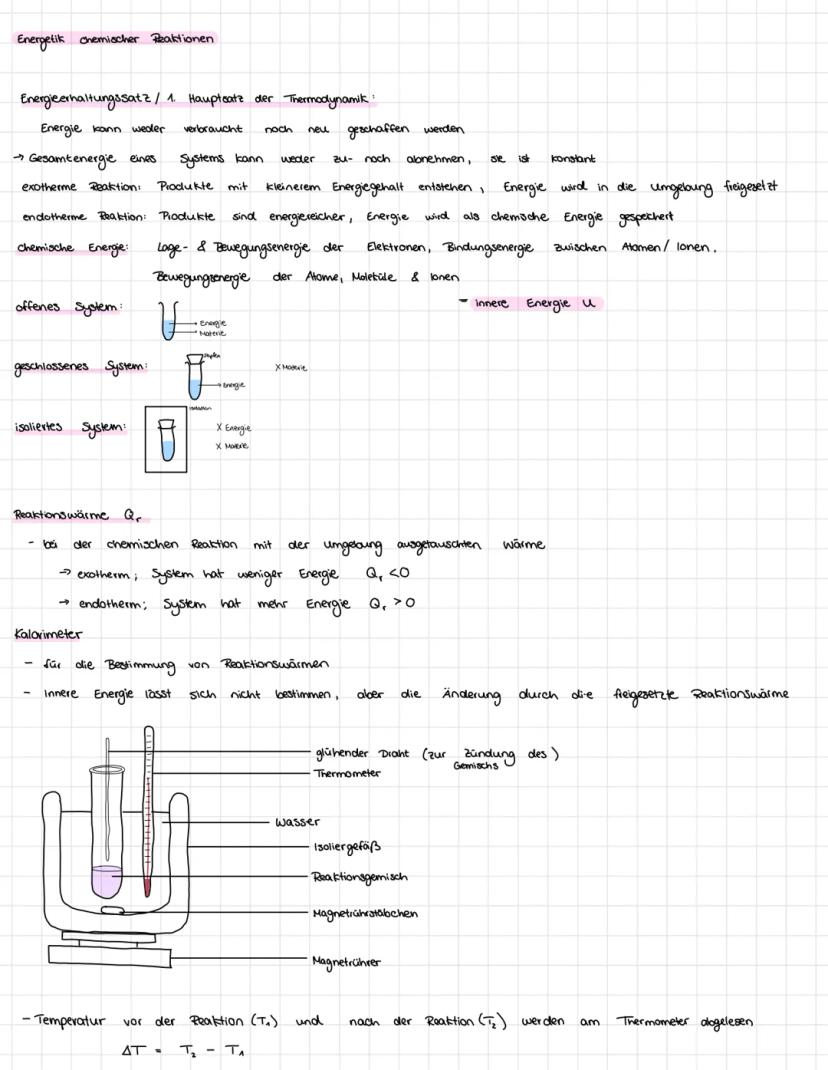
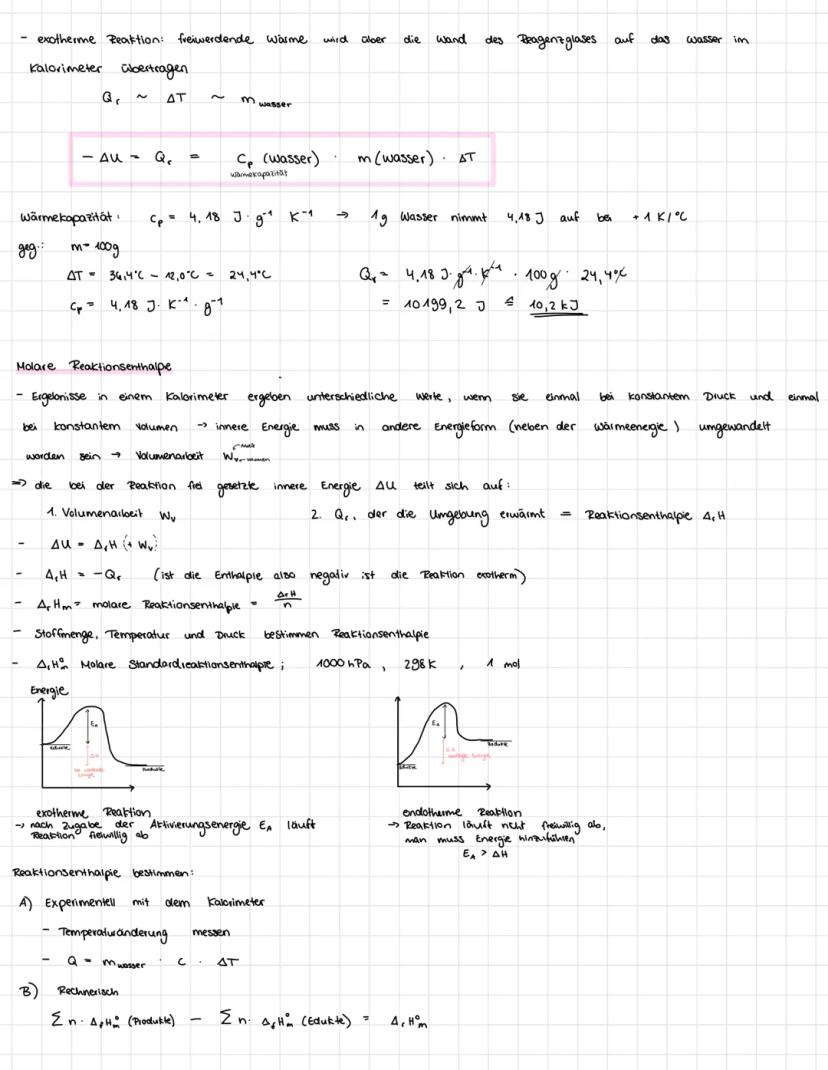
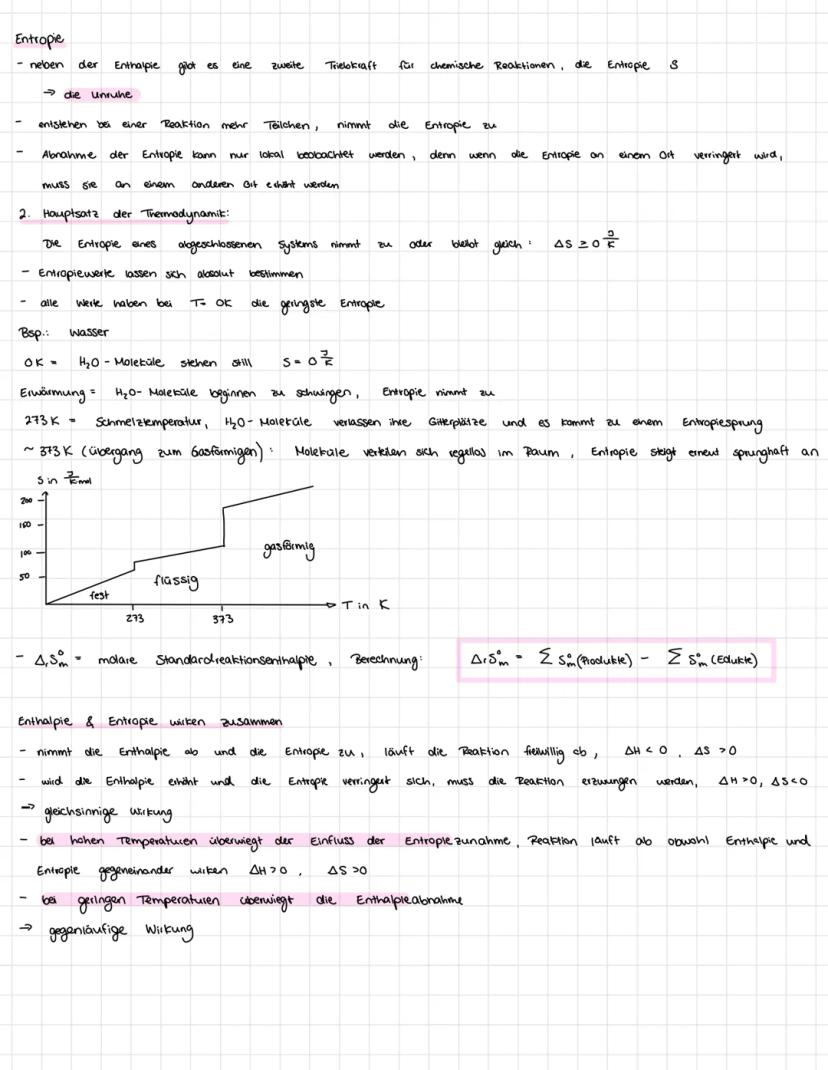
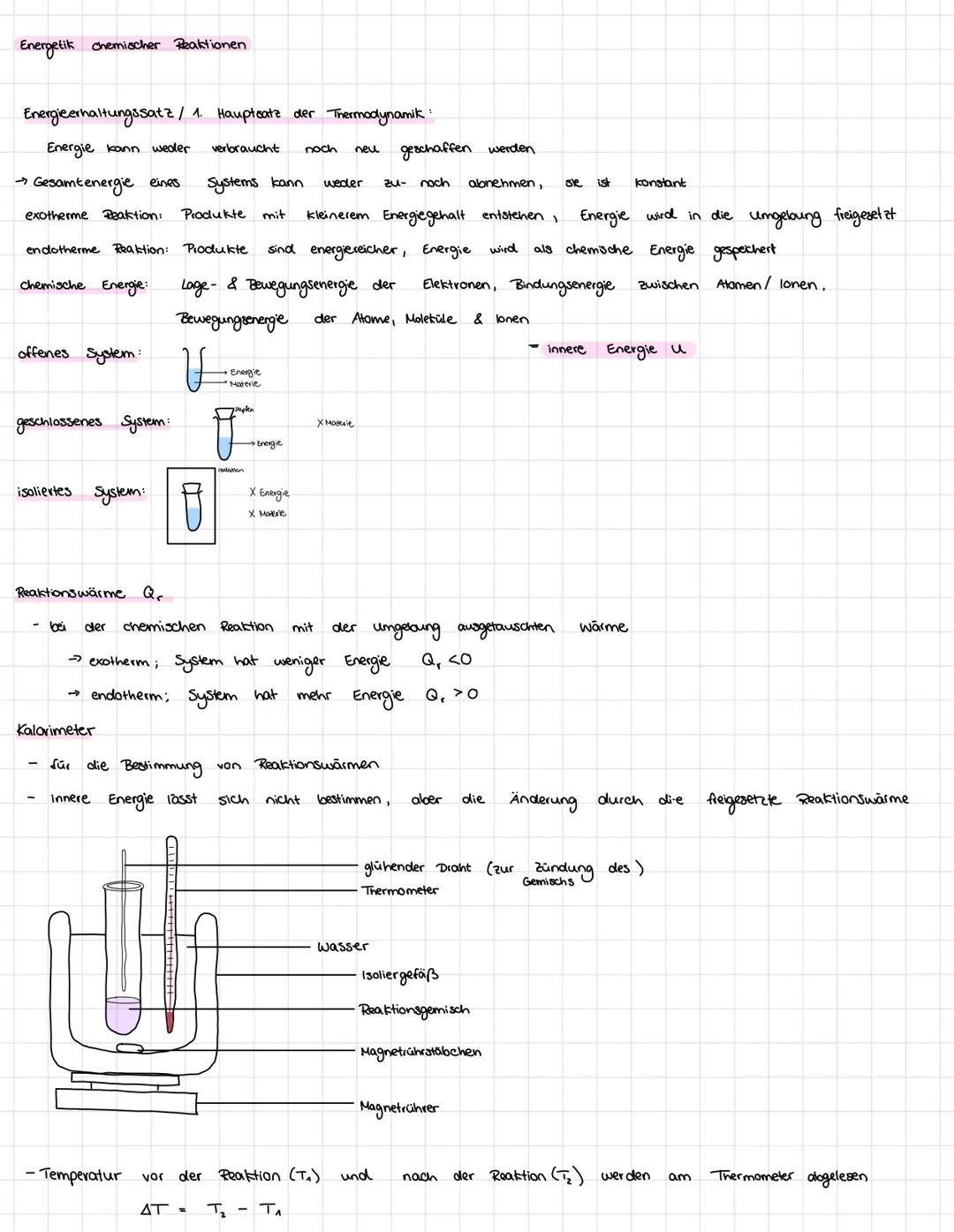
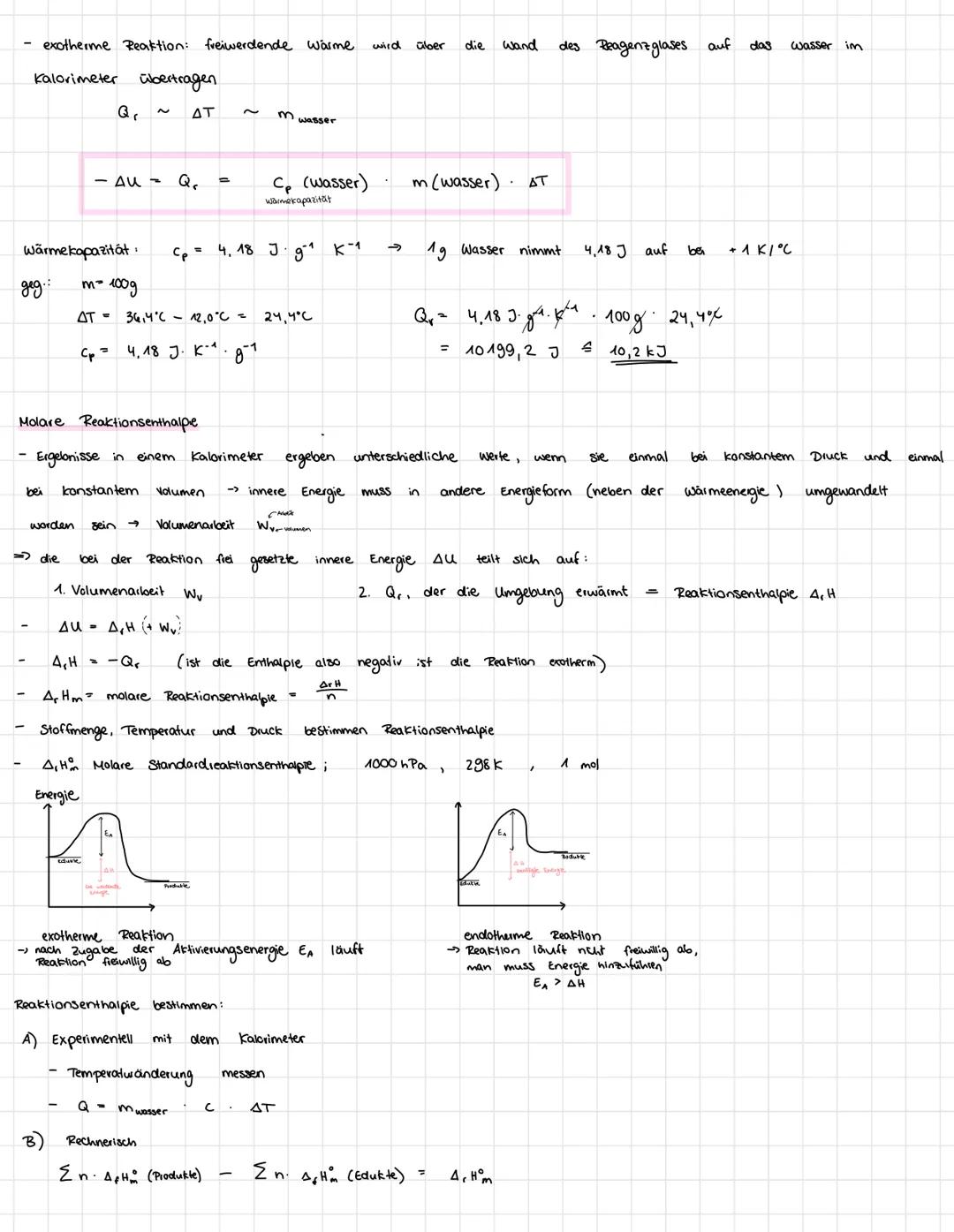
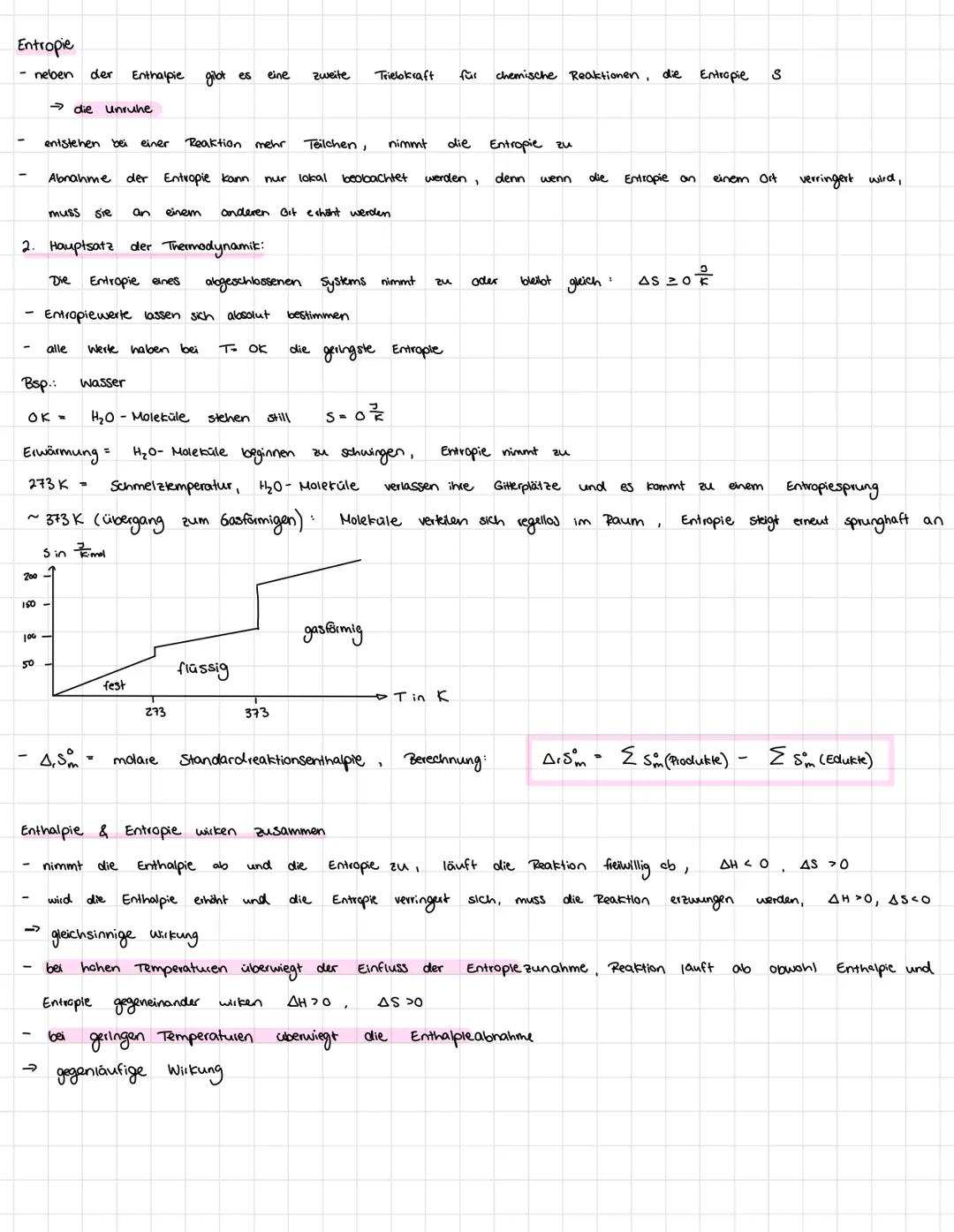
Kraftfahrzeugbenzin und Ottomotor
Benzin muss veredelt werden, bevor es in modernen Motoren funktioniert. Der Ottomotor arbeitet in vier Takten: Ansaugen von Benzin-Luft-Gemisch, Komprimieren, Zünden durch Zündkerze, Ausstoßen der Verbrennungsgase.
Das Problem: Klopfende Verbrennung entsteht, wenn sich das Gemisch unkontrolliert selbst entzündet, bevor die Flammenfront ankommt. Diese Sekundärzündungen erzeugen Druckstöße, die den Motor beschädigen können.
Die Oktanzahl misst die Klopffestigkeit. 2,2,4-Trimethylpentan hat Oktanzahl 100 (sehr klopffest), n-Heptan hat 0 (sehr klopffreudig). Je mehr Verzweigungen ein Alkan hat, desto klopffester ist es.
Tankstellen-Wissen: Super Plus (98 Oktan) ist klopffester als Super (95 Oktan) - aber nur Sportwagen brauchen das wirklich!