Reaktionsgeschwindigkeit - Wer bestimmt das Tempo?
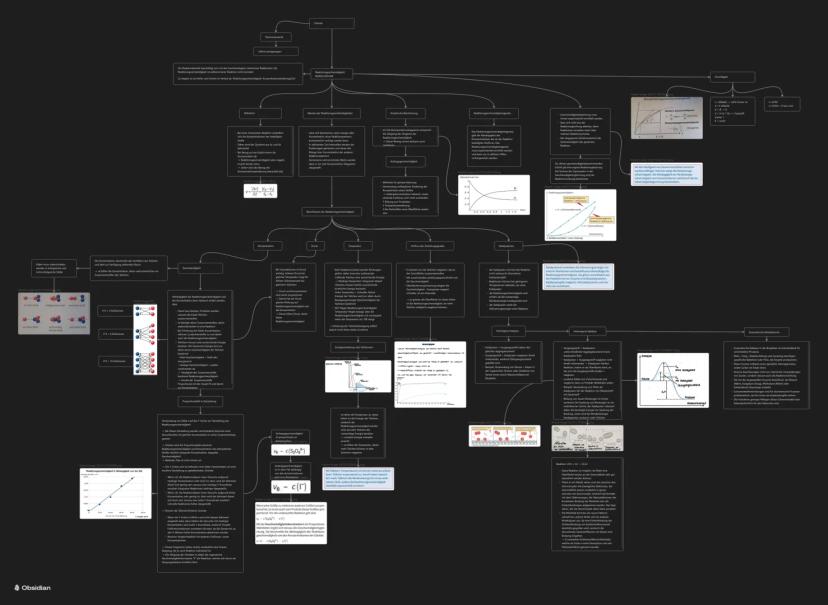
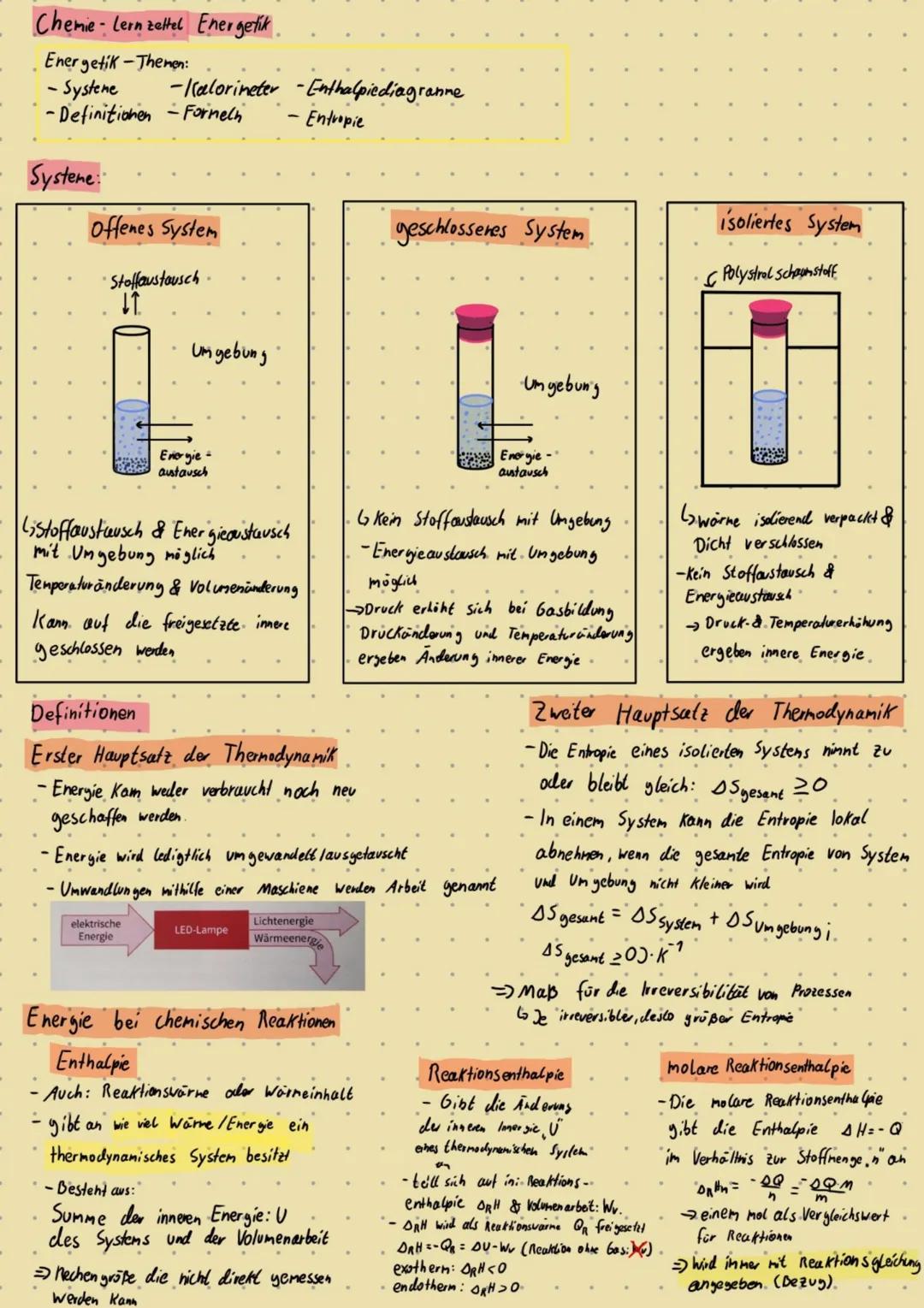
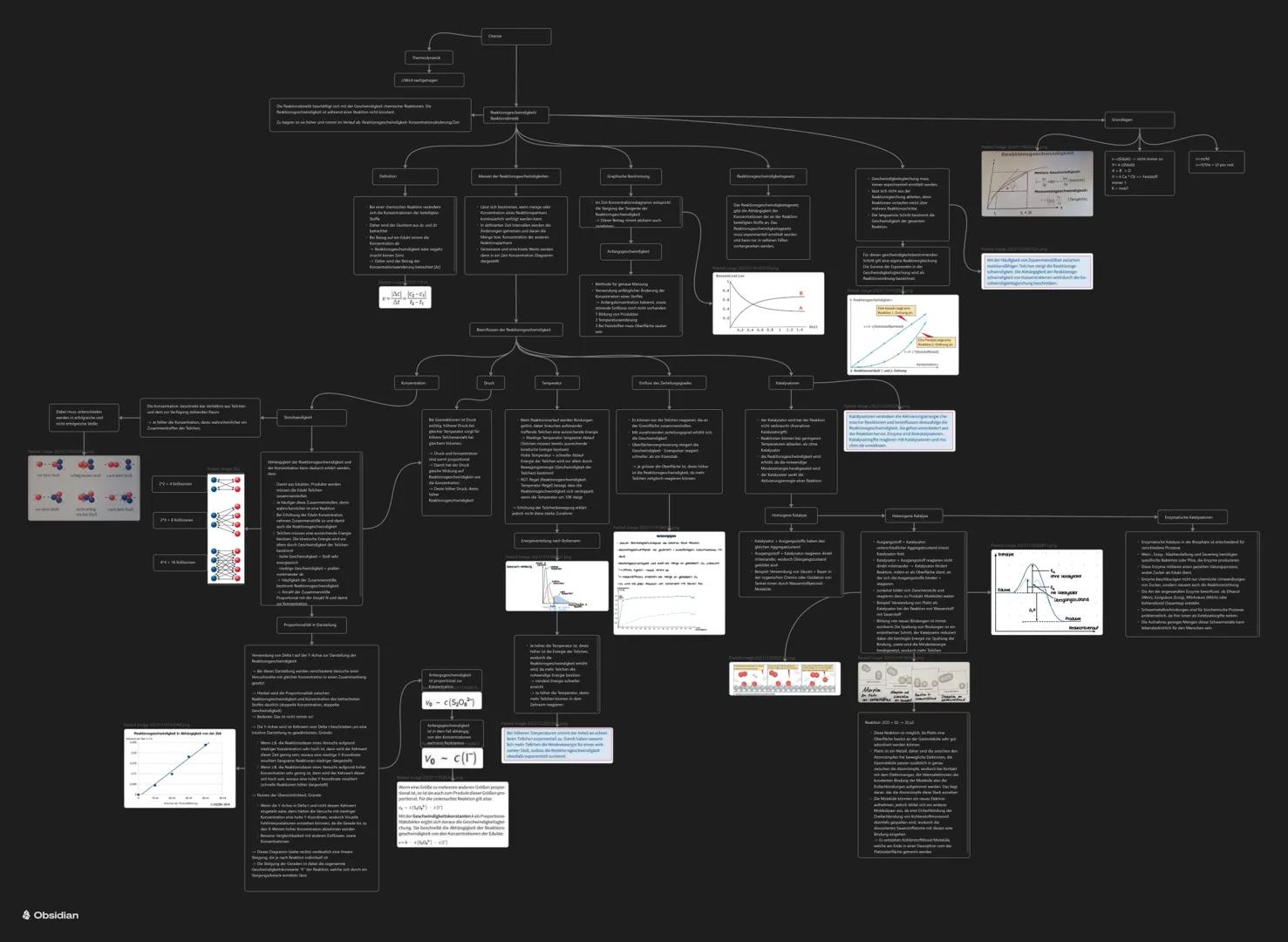
Die Reaktionsgeschwindigkeit v = Δc/Δt sagt euch nur, wie schnell eine Reaktion läuft - nicht, ob oder wohin sie läuft. Das ist ein wichtiger Unterschied zur Thermodynamik!
Einflussfaktoren auf die Geschwindigkeit sind logisch: Höhere Konzentration → mehr Teilchen → mehr Kollisionen → schneller. Höhere Temperatur → mehr Energie → häufigere erfolgreiche Stöße.
Druck wirkt wie Konzentration bei Gasen: mehr Druck = dichtere Packung = mehr Kollisionen. Der Zerteilungsgrad vergrößert die Oberfläche und beschleunigt dadurch die Reaktion.
Katalysatoren sind die Superhelden der Chemie: Sie beschleunigen Reaktionen, ohne selbst verbraucht zu werden. Sie senken die Aktivierungsenergie durch Bildung von Zwischenkomplexen.
Bei homogener Katalyse sind Katalysator und Reaktanten in derselben Phase, bei heterogener in verschiedenen Phasen. Enzyme sind biologische Katalysatoren - extrem spezifisch und effektiv.
Wichtig: Katalysatoren ändern nicht das Gleichgewicht, sondern nur die Geschwindigkeit, mit der es erreicht wird!