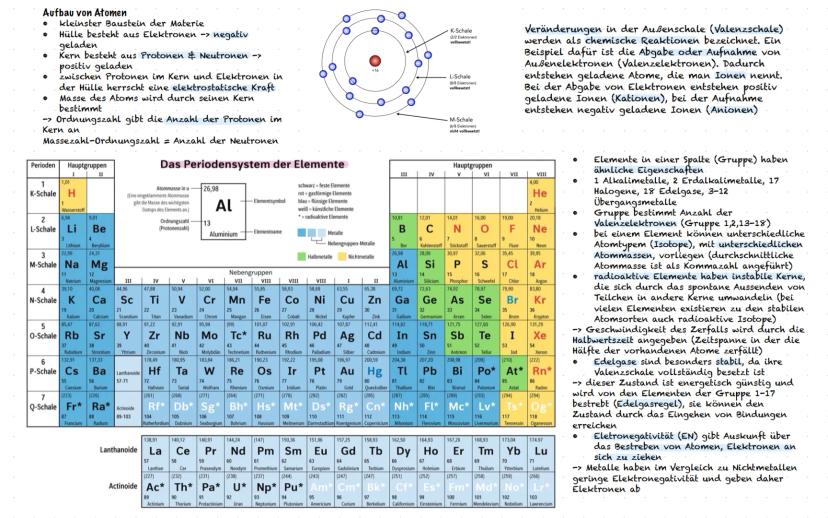
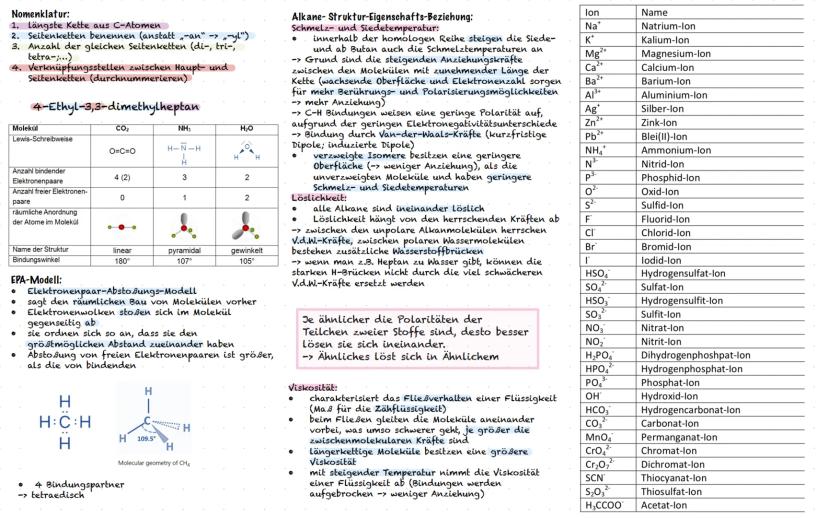
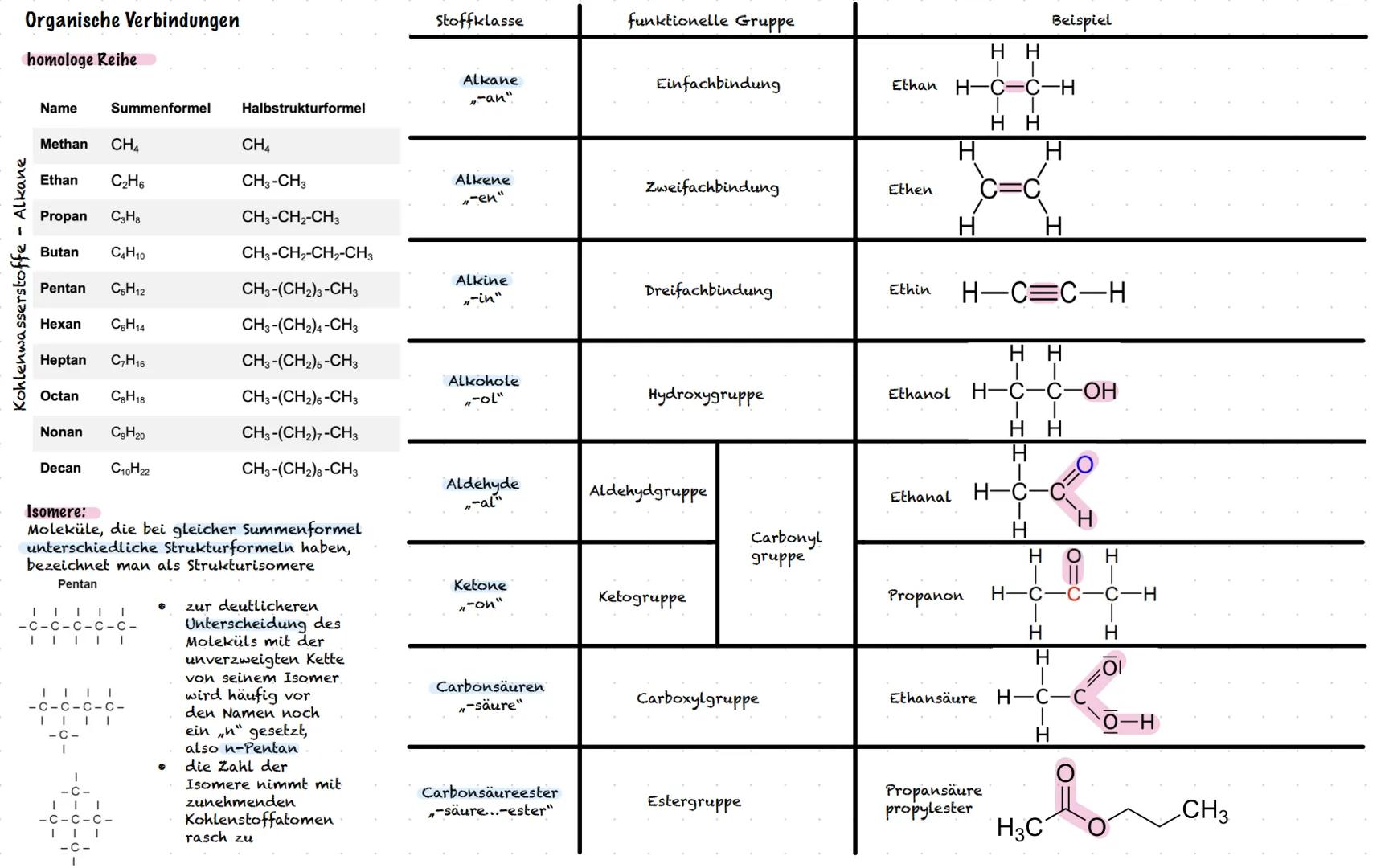
Nomenklatur und Eigenschaften von Alkanen
Die Nomenklatur organischer Moleküle folgt klaren Regeln, wie eine Bauanleitung. Finde zuerst die längste Kohlenstoffkette (Grundname), benenne die Seitenketten aus"−an"wird"−yl", zähle gleiche Gruppen di−,tri−,tetra− und nummeriere die Positionen durch. So wird aus einem komplizierten Molekül ein verständlicher Name wie "4-Ethyl-3,3-dimethylheptan".
Die physikalischen Eigenschaften von Alkanen folgen logischen Mustern. Längere Ketten haben höhere Siede- und Schmelzpunkte, weil mehr Van-der-Waals-Kräfte zwischen den Molekülen wirken. Verzweigte Moleküle haben kleinere Oberflächen und daher niedrigere Temperaturen als ihre unverzweigten Isomere.
Das EPA-Modell Elektronenpaar−Abstoßungs−Modell hilft dir, die räumliche Struktur von Molekülen vorherzusagen. Elektronenwolken stoßen sich ab und ordnen sich für maximalen Abstand an. Methan hat zum Beispiel eine tetraedrische Form mit 109,5° Bindungswinkeln.
Löslichkeit folgt der Regel "Ähnliches löst sich in Ähnlichem". Unpolare Alkane lösen sich gut ineinander, aber schlecht in polarem Wasser. Die Viskosität steigt mit der Kettenlänge - längere Moleküle fließen zäher, weil sie stärker aneinander haften.
Praxistipp: Bei Nomenklatur-Aufgaben immer systematisch vorgehen: längste Kette → Seitenketten → Anzahl → Positionen. Diese Reihenfolge führt dich sicher zum Ziel!