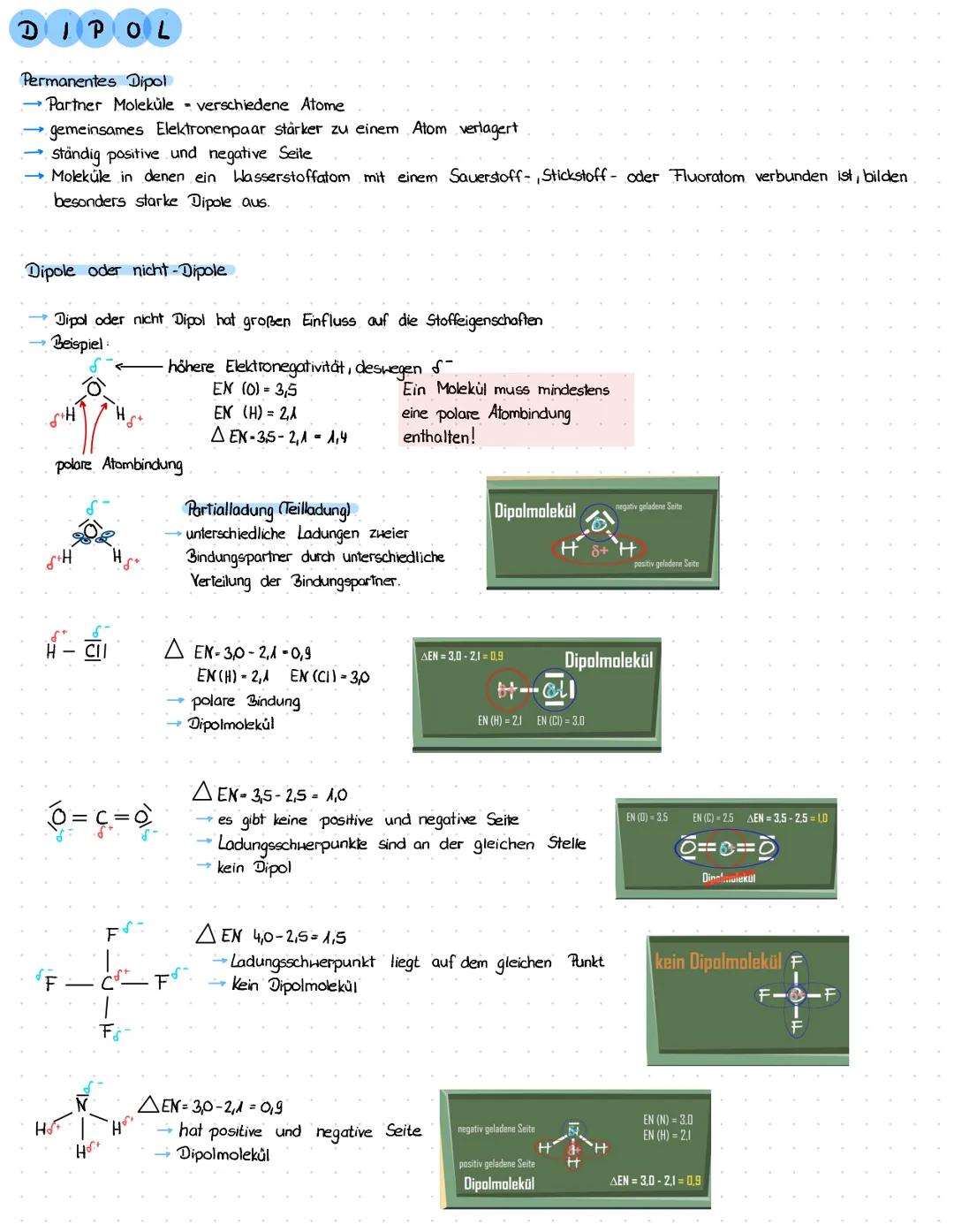
Was sind Dipole und wie entstehen sie?
Dipole entstehen, wenn sich Elektronen in einem Molekül ungleichmäßig verteilen. Das passiert immer dann, wenn verschiedene Atome miteinander verbunden sind, die unterschiedlich stark an den Elektronen "ziehen".
Die Stärke, mit der ein Atom Elektronen anzieht, nennt man Elektronegativität (EN). Wasserstoff hat zum Beispiel EN = 2,1 und Chlor EN = 3,0. Wenn du die Differenz berechnest ΔEN=3,0−2,1=0,9, kannst du vorhersagen, ob ein Dipol entsteht.
Bei HCl zieht Chlor die Elektronen stärker an sich - dadurch wird die Chlor-Seite leicht negativ (δ-) und die Wasserstoff-Seite leicht positiv (δ+). Diese Partialladungen machen das Molekül zu einem permanenten Dipol.
Merktipp: Besonders starke Dipole entstehen, wenn Wasserstoff mit Sauerstoff, Stickstoff oder Fluor verbunden ist - diese Kombis sind echte "Elektronenräuber"!
Aber Achtung: Auch wenn einzelne Bindungen polar sind, muss das ganze Molekül noch lange kein Dipol sein! Bei CF₄ sind zwar alle C-F-Bindungen polar, aber durch die symmetrische Anordnung heben sich die Ladungen gegenseitig auf - kein Dipolmolekül.