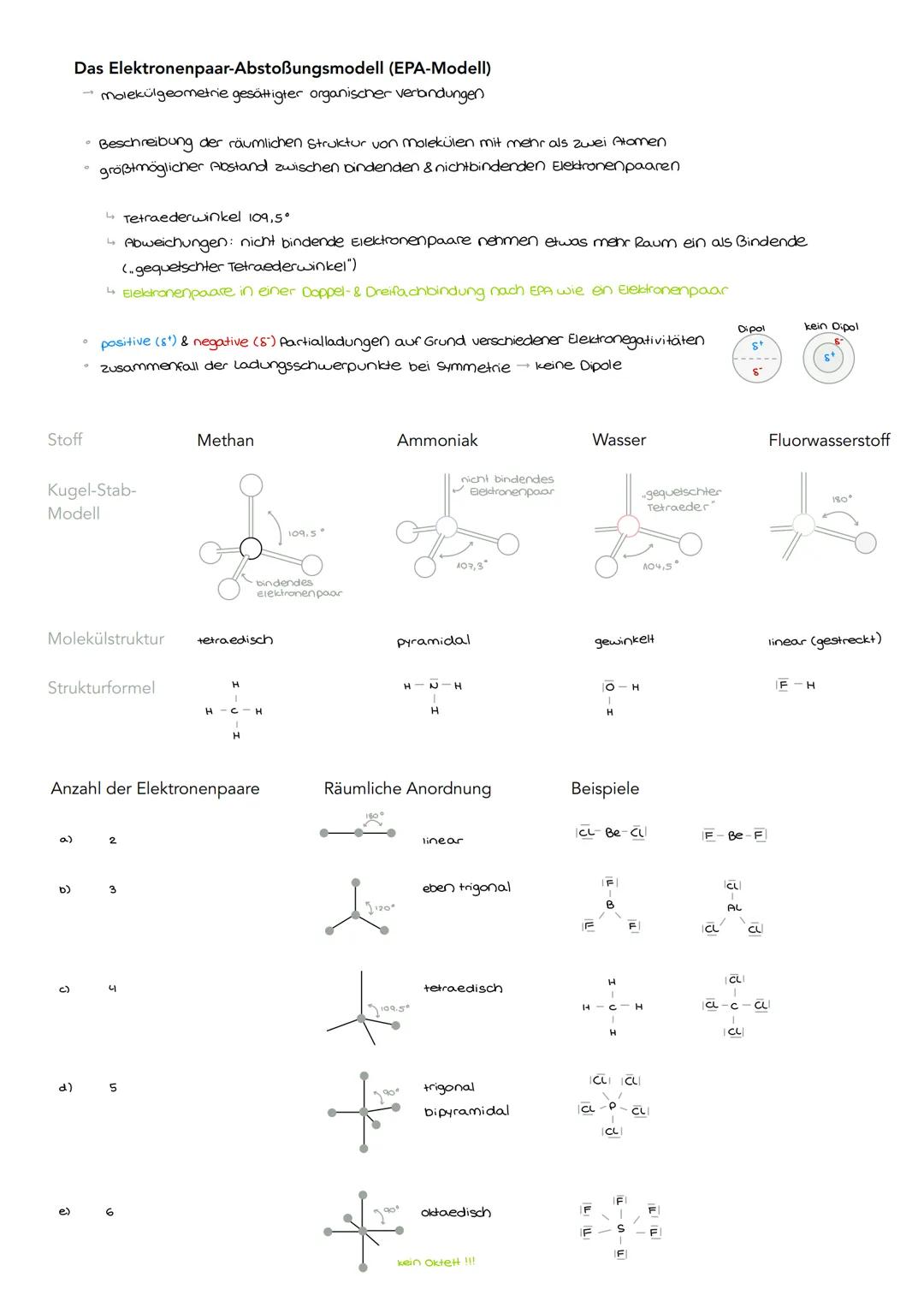
Das Elektronenpaar-Abstoßungsmodell EPA−Modell
Du kennst sicher die Grundregel: Gleiche Ladungen stoßen sich ab. Genau das passiert auch bei Elektronenpaaren in Molekülen - sie wollen so weit wie möglich voneinander weg sein. Das EPA-Modell erklärt dir, warum Moleküle ihre spezifischen räumlichen Strukturen haben.
Der Tetraederwinkel von 109,5° ist dabei besonders wichtig. Er entsteht, wenn vier Elektronenpaare um ein Zentralatom angeordnet sind - wie bei Methan (CH₄). Aber Vorsicht: Nicht bindende Elektronenpaare brauchen etwas mehr Platz als bindende, weshalb die Winkel manchmal "gequetscht" werden.
Bei Doppel- und Dreifachbindungen zählen alle Elektronenpaare zusammen wie ein einziges Paar. Das macht die Vorhersage der Molekülform viel einfacher.
Merktipp: Je mehr Elektronenpaare vorhanden sind, desto komplexer wird die räumliche Anordnung - von linear (2 Paare) bis oktaedrisch (6 Paare).
Partialladungen entstehen durch unterschiedliche Elektronegativitäten und können zu Dipolen führen. Bei symmetrischen Molekülen heben sich diese jedoch auf - dann gibt es keinen Dipol.