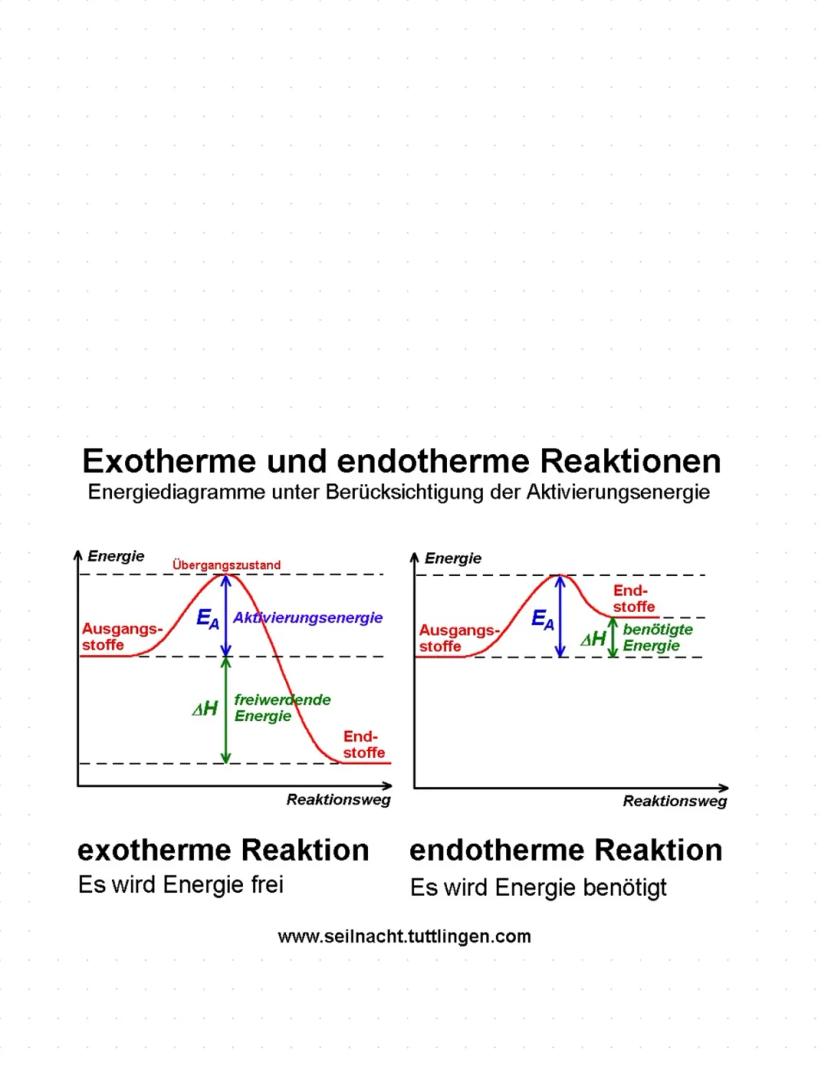
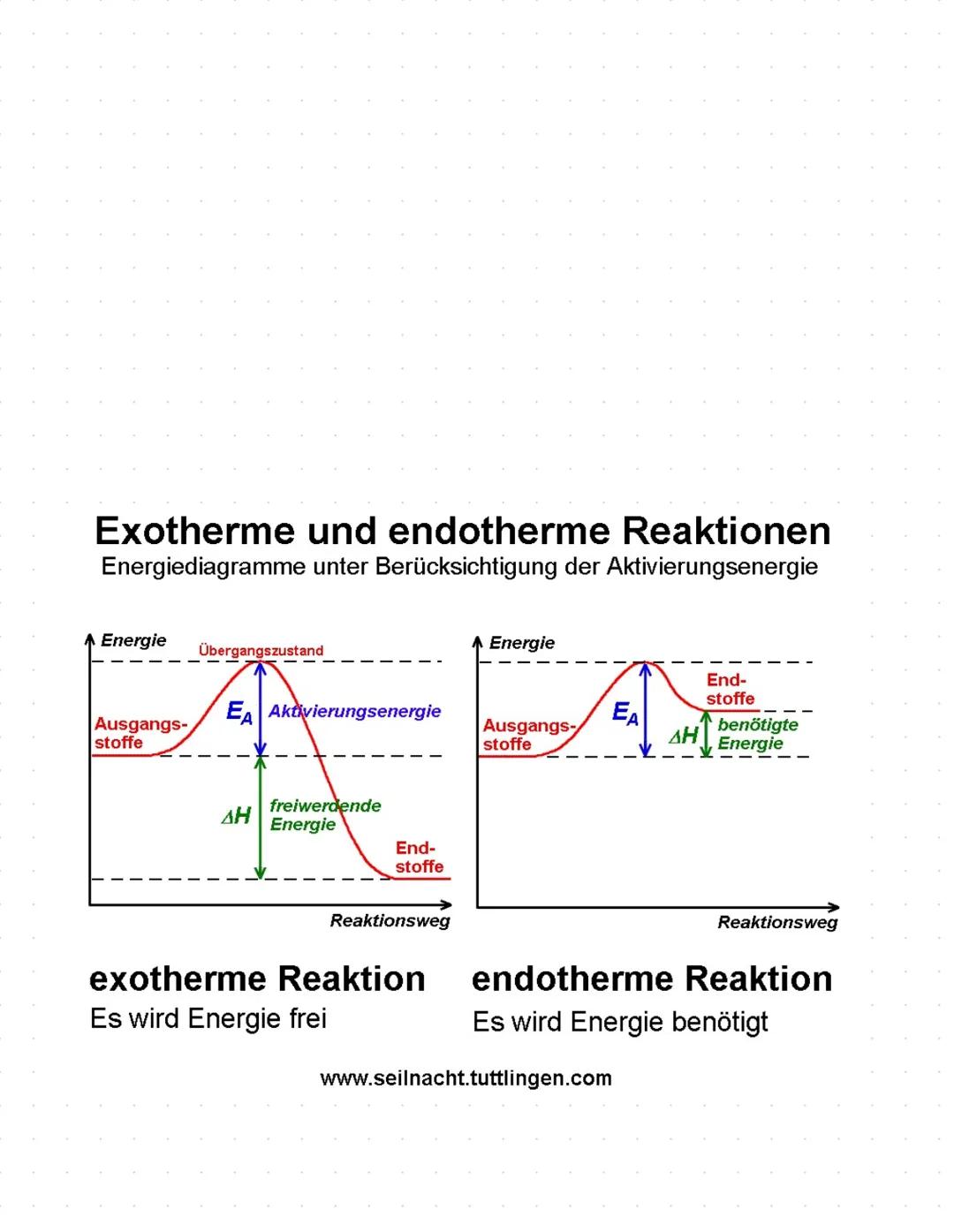
Bindungsarten und Redoxreaktionen
Ionenbindungen entstehen zwischen Metallen und Nichtmetallen - ein Partner gibt Elektronen ab, der andere nimmt sie auf. So entstehen entgegengesetzt geladene Ionen, die sich anziehen.
Atombindungen (kovalente Bindungen) findest du bei Nichtmetallen, die sich Elektronen teilen. Mit Lewis-Strukturformeln kannst du diese Bindungen zeichnen - jedes Atom will 8 Elektronen in der äußeren Schale haben.
Redoxreaktionen sind Reaktionen mit Elektronenübertragung. Oxidation bedeutet Elektronen abgeben, Reduktion bedeutet Elektronen aufnehmen. Beide laufen immer gleichzeitig ab.
Eselsbrücke: OIL RIG - Oxidation Is Loss (of electrons), Reduction Is Gain (of electrons).
Elektronegativität beschreibt, wie stark ein Atom Elektronen anzieht. Sie steigt im Periodensystem von links nach rechts und von unten nach oben. Das erklärt, warum manche Bindungen polar sind.