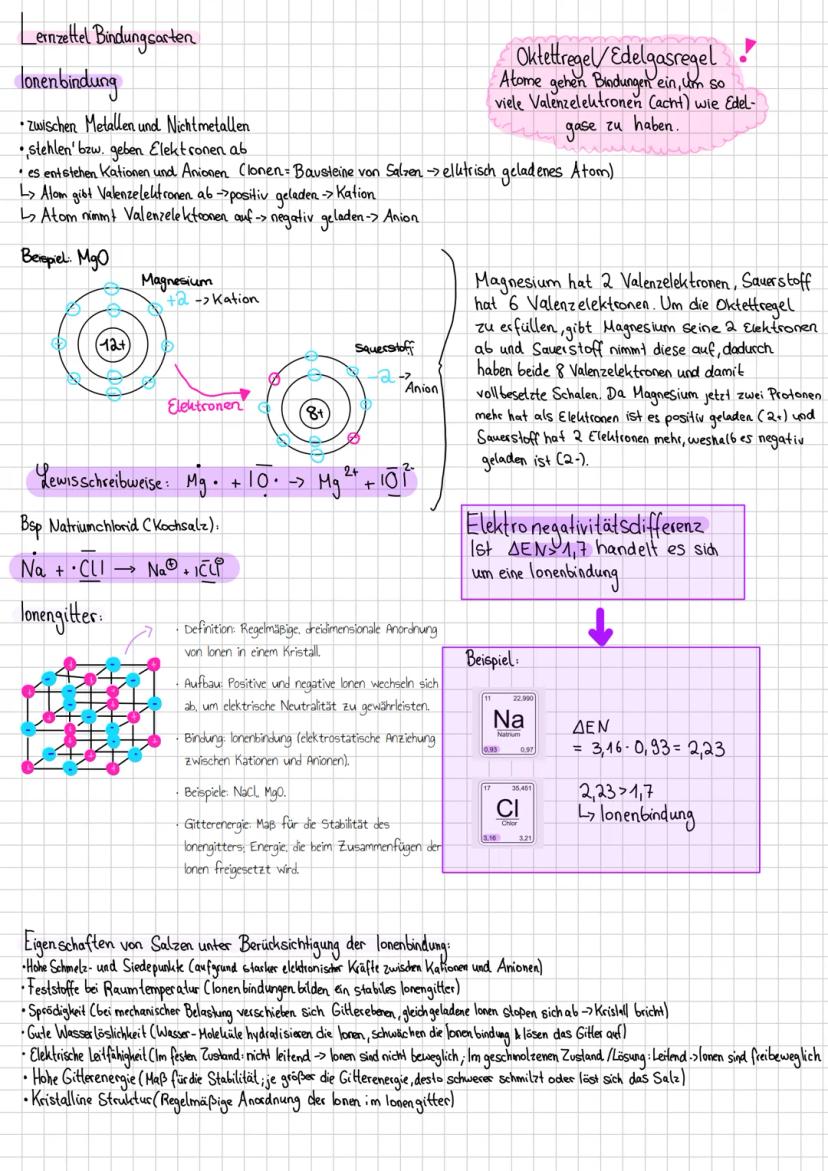
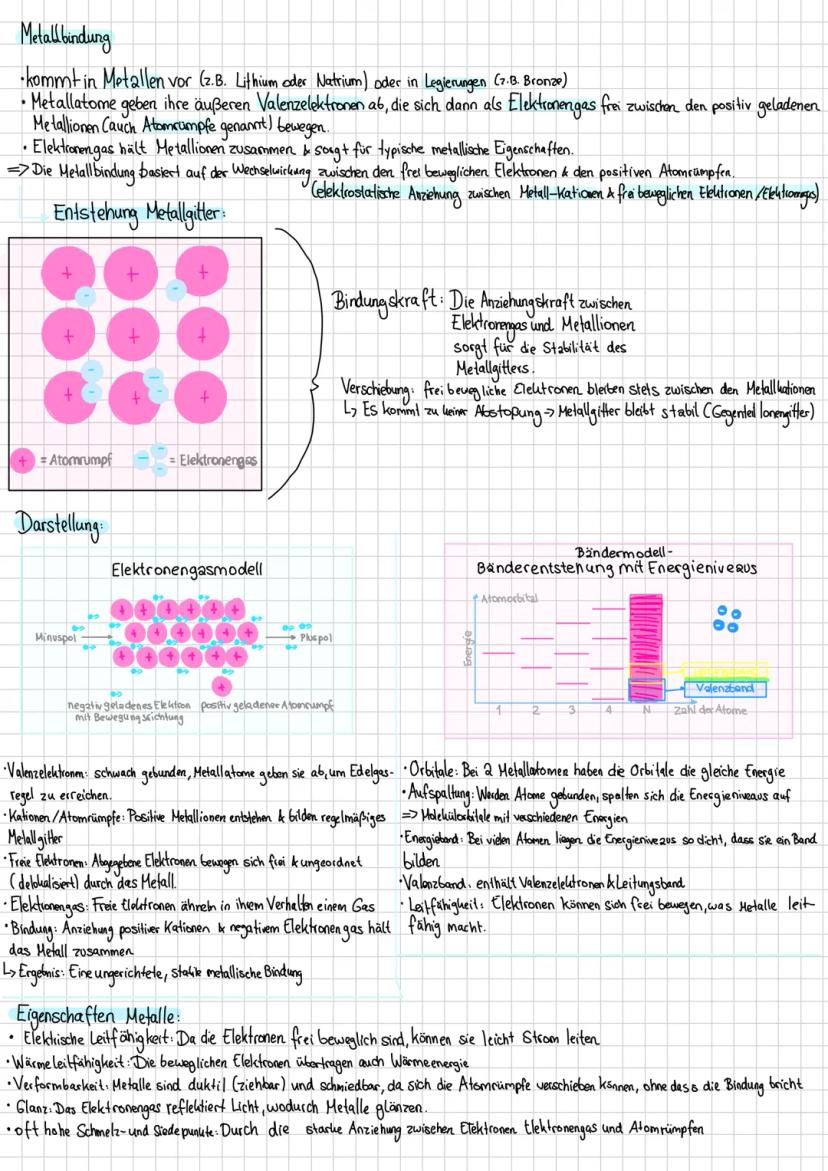
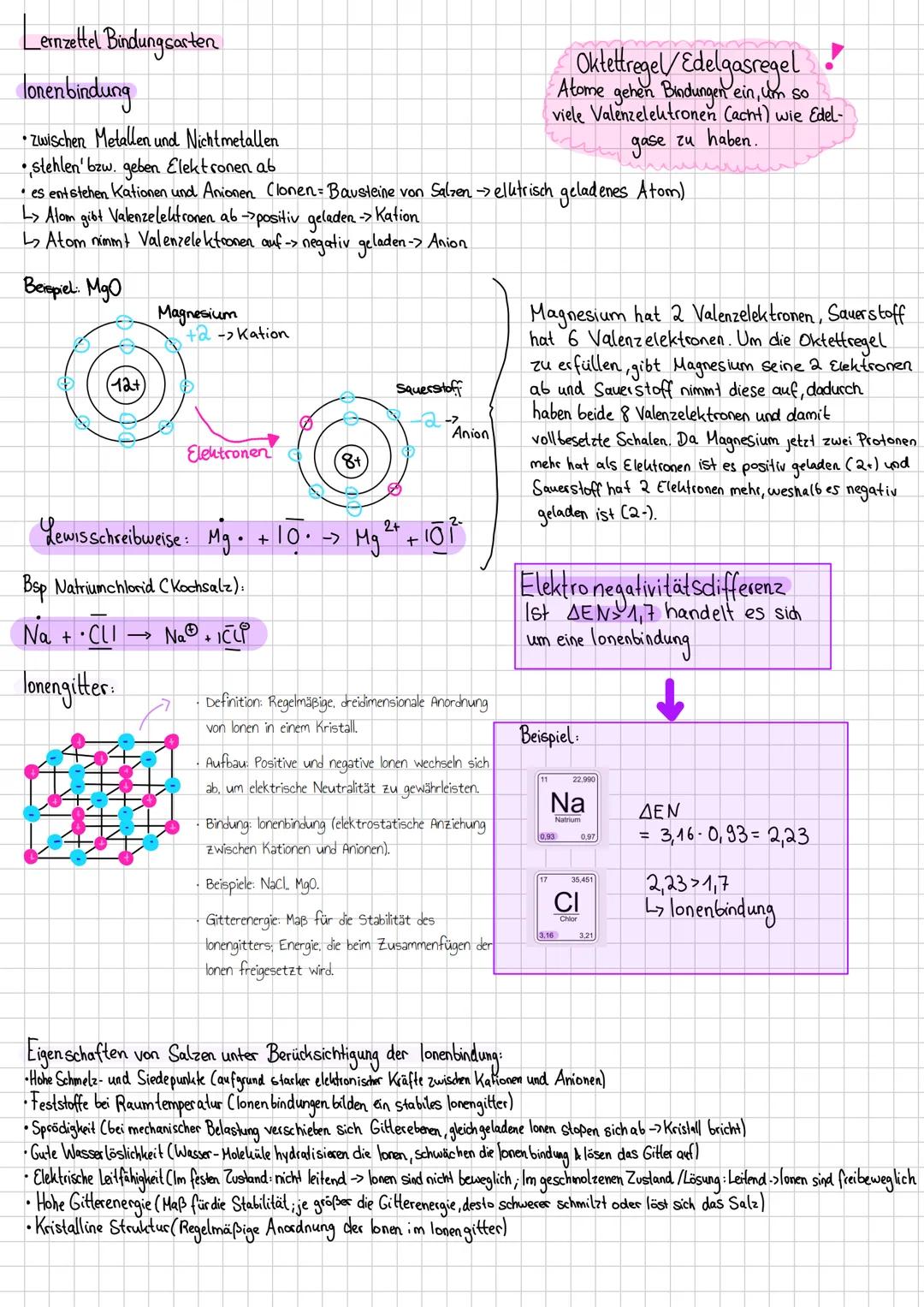
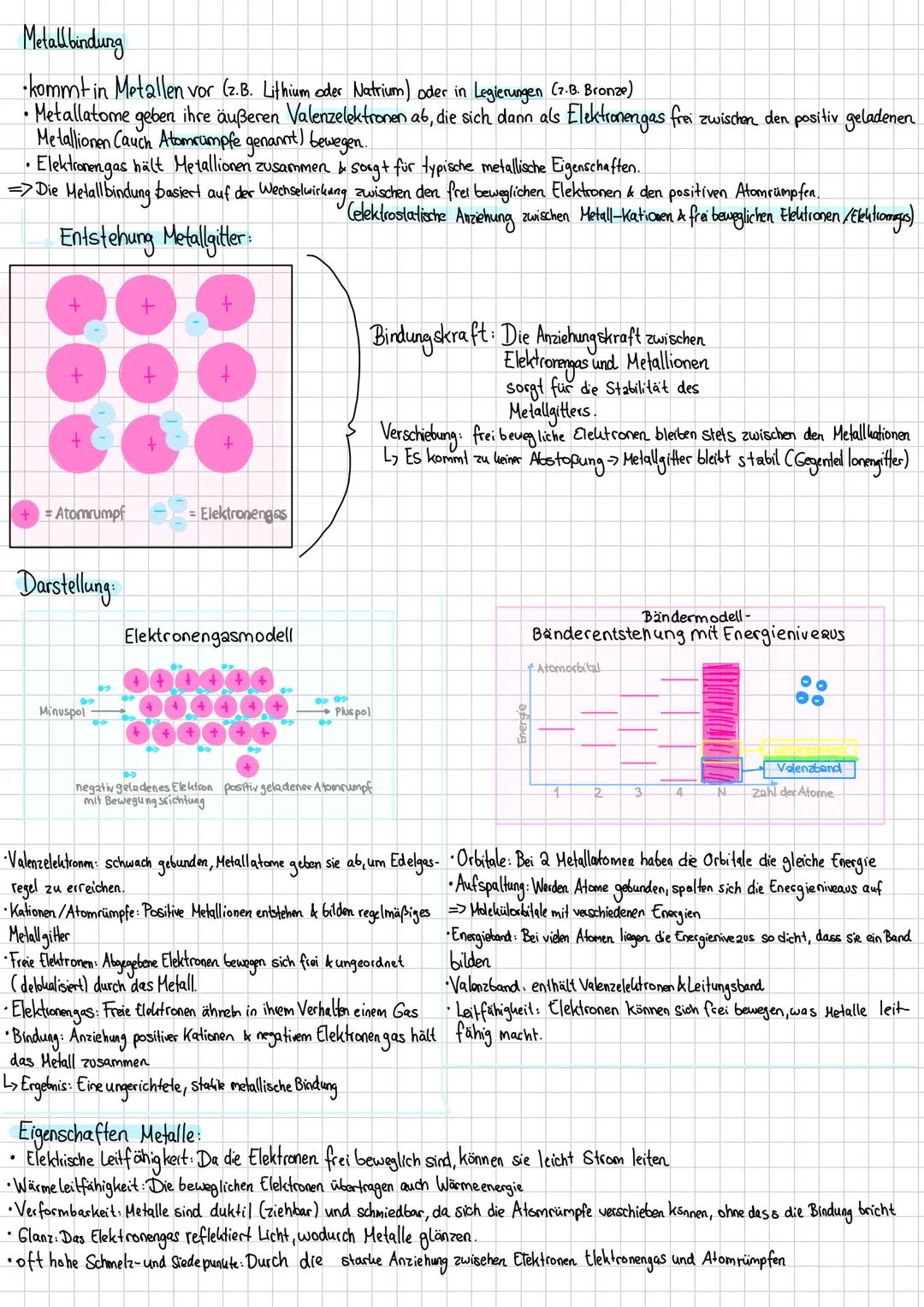
Dipole und zwischenmolekulare Kräfte
Ein Dipol ist wie ein winziger Magnet mit Plus- und Minuspol. Entstehen tut er, wenn polare Bindungen in unsymmetrischen Molekülen die Elektronen ungleichmäßig verteilen - eine Seite wird δ⁻, die andere δ⁺.
Der Trick liegt in der Geometrie: CO₂ hat zwar polare C=O-Bindungen, aber durch die lineare, symmetrische Form heben sich die Ladungen auf - kein Dipol. Wasser dagegen ist gewinkelt gebaut, deshalb bleibt es polar und wird zum Dipol.
Hier wird's wichtig: Chemische Bindungen Atom−,Ionen−,Metallbindung halten die Atome innerhalb von Molekülen zusammen - sie sind stark! Zwischenmolekulare Kräfte dagegen wirken zwischen verschiedenen Molekülen und sind deutlich schwächer.
Eselsbrücke: Chemische Bindungen = Binnen-Bindungen (innerhalb), zwischenmolekulare Kräfte = Zwischen-Bindungen (zwischen Molekülen).
Diese zwischenmolekularen Kräfte bestimmen physikalische Eigenschaften wie Siedepunkt oder Löslichkeit. Wasser hat wegen seiner starken Wasserstoffbrücken einen hohen Siedepunkt von 100°C, während Methan mit schwachen Van-der-Waals-Kräften schon bei -162°C siedet.