Struktur-Eigenschafts-Beziehungen und Oxidationszahlen
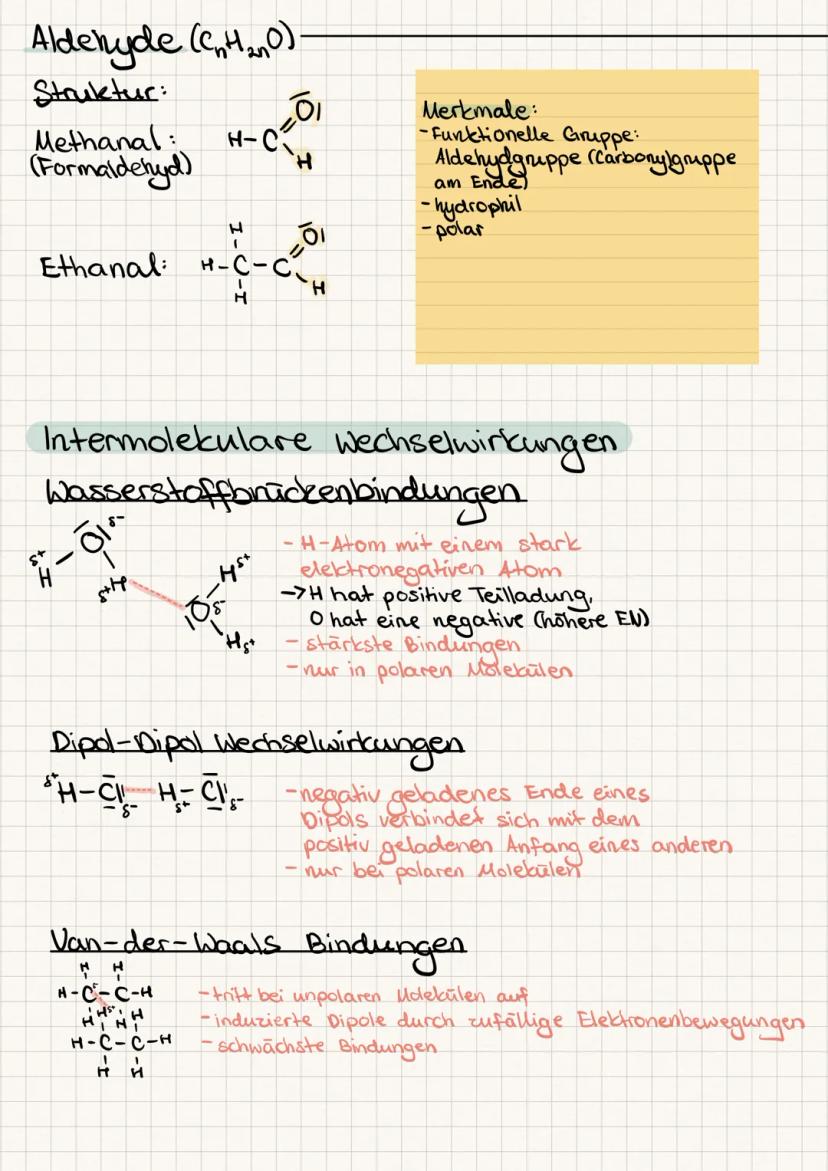
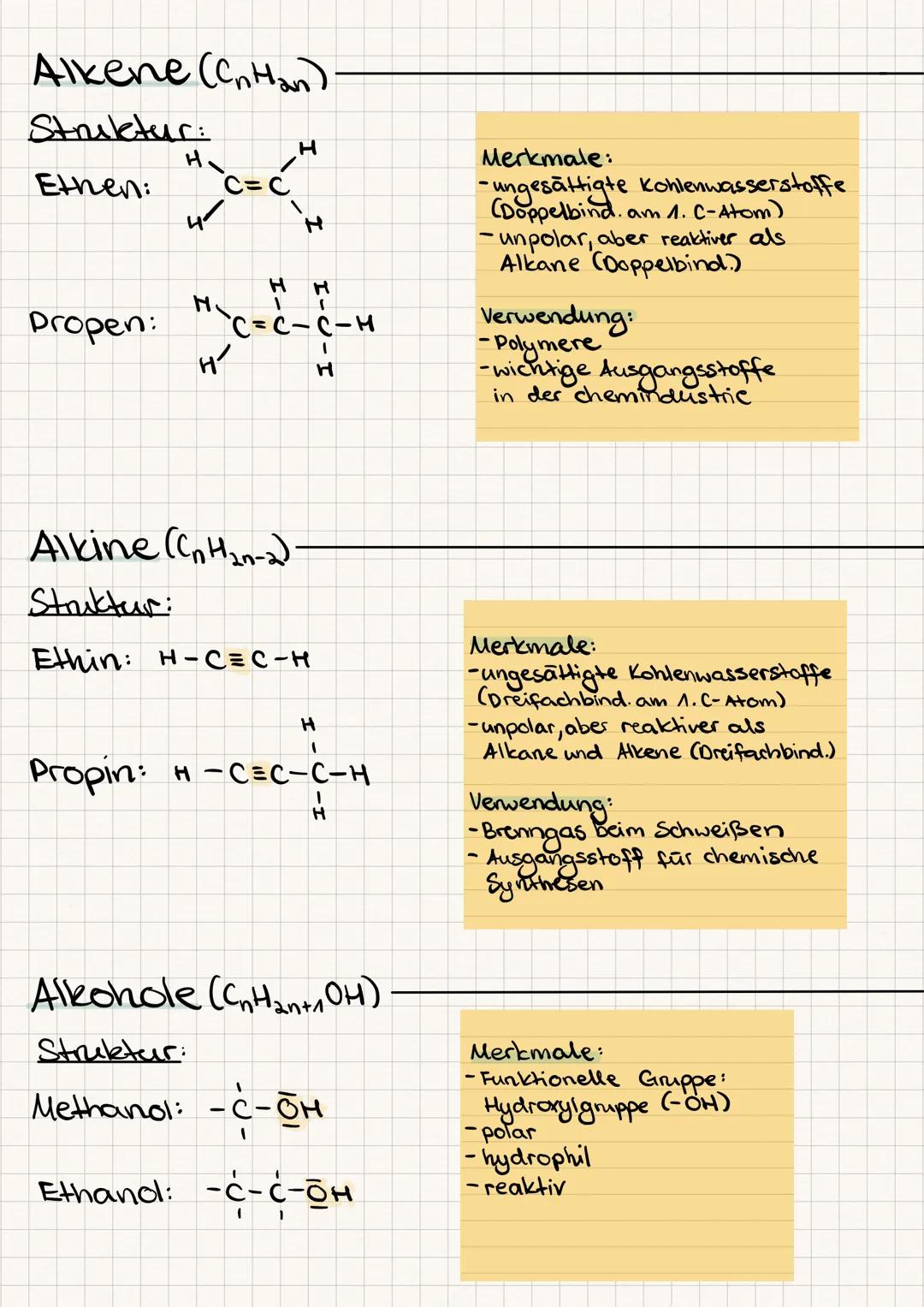
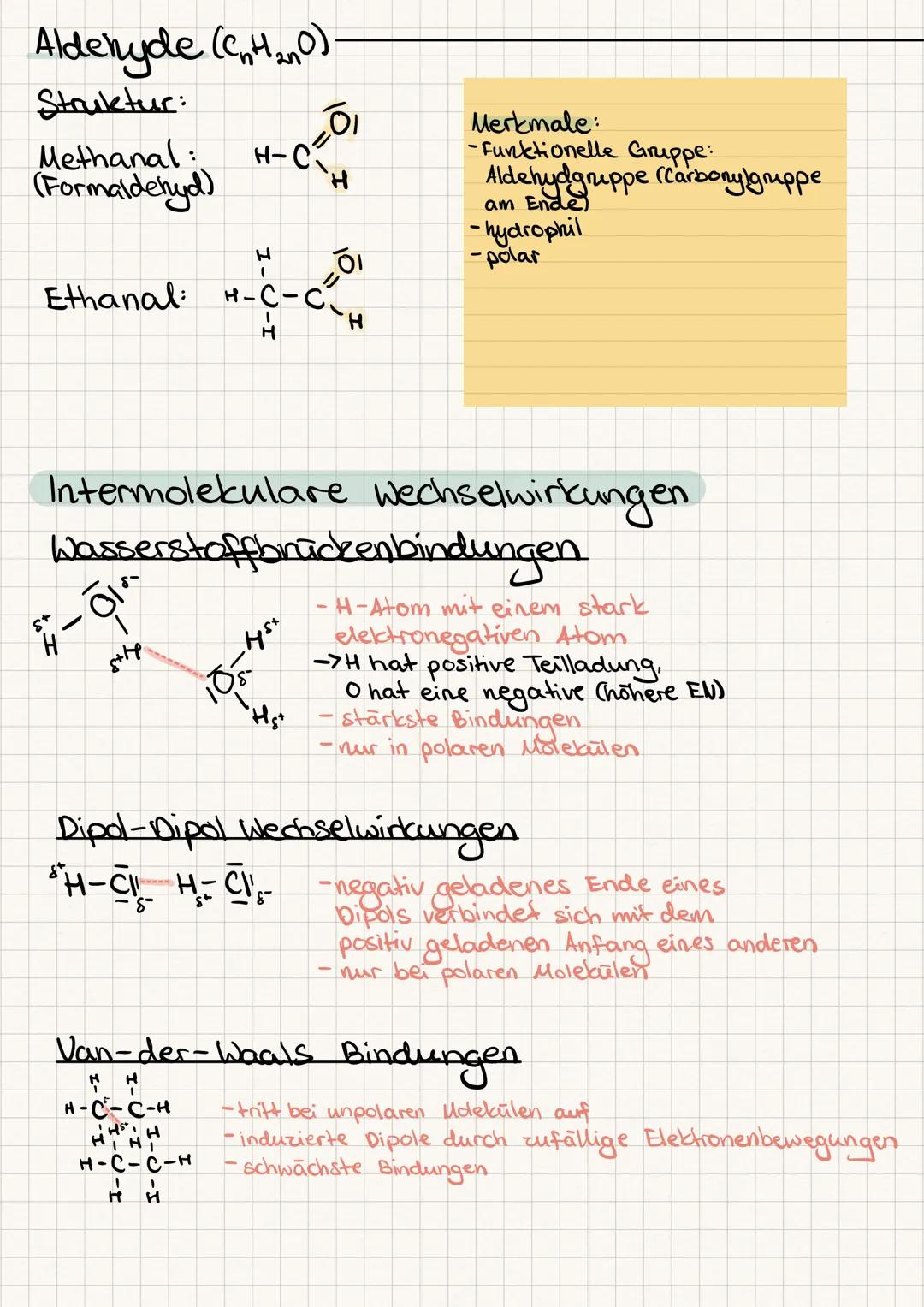
Siedepunkt und Schmelzpunkt steigen mit der Kettenlänge und hängen von den Bindungstypen ab. Wasserstoffbrücken sind schwerer zu knacken als Van-der-Waals-Kräfte - deshalb hat Wasser einen so hohen Siedepunkt.
Elektronegativität zeigt dir, wer die Elektronen im Molekül an sich zieht. Bei Elektronegativitätsdifferenzen von 0-0,4 hast du unpolare, bei 0,5-1,7 polare und über 1,7 ionische Bindungen.
Oxidationszahlen sind fiktive Ladungen, die dir bei Redoxreaktionen helfen. Wasserstoff ist meist +1, Sauerstoff -2, und elementare Stoffe haben immer 0.
Merkhilfe: Polare Moleküle lösen sich in Wasser, unpolare in Fett - "Gleiches löst Gleiches" ist dein Mantra für Löslichkeit!