Chemische Bindungen verstehen
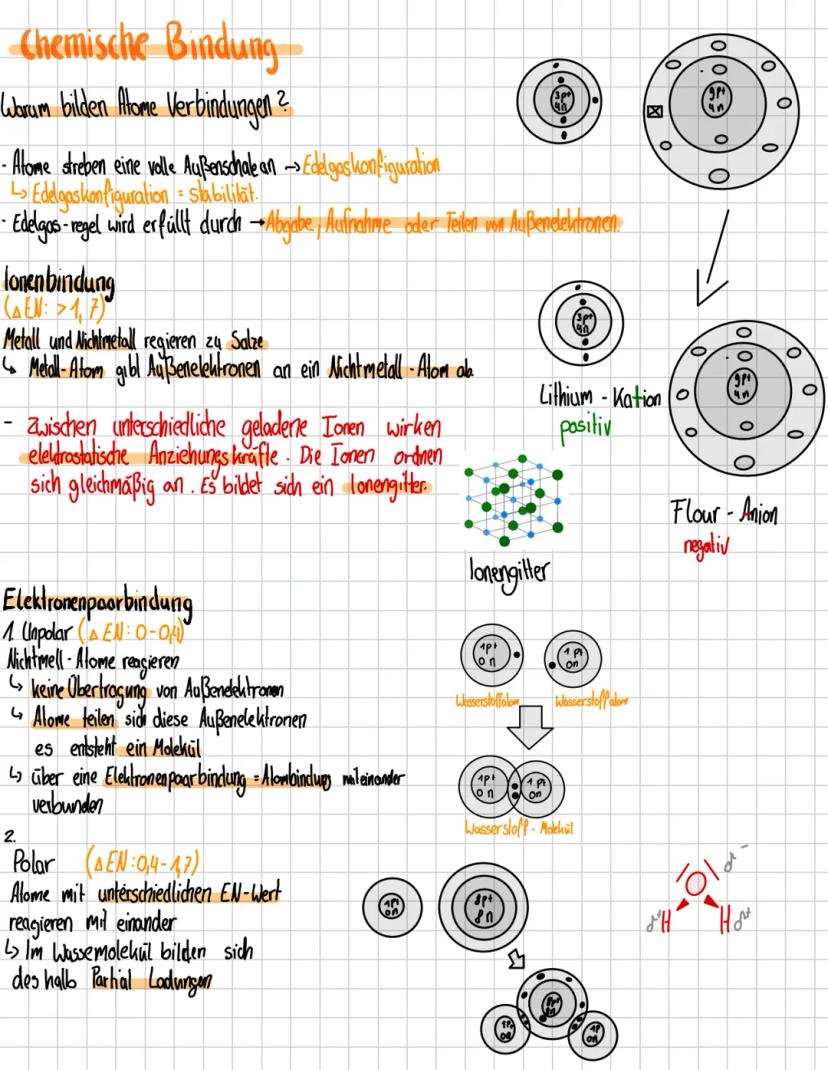
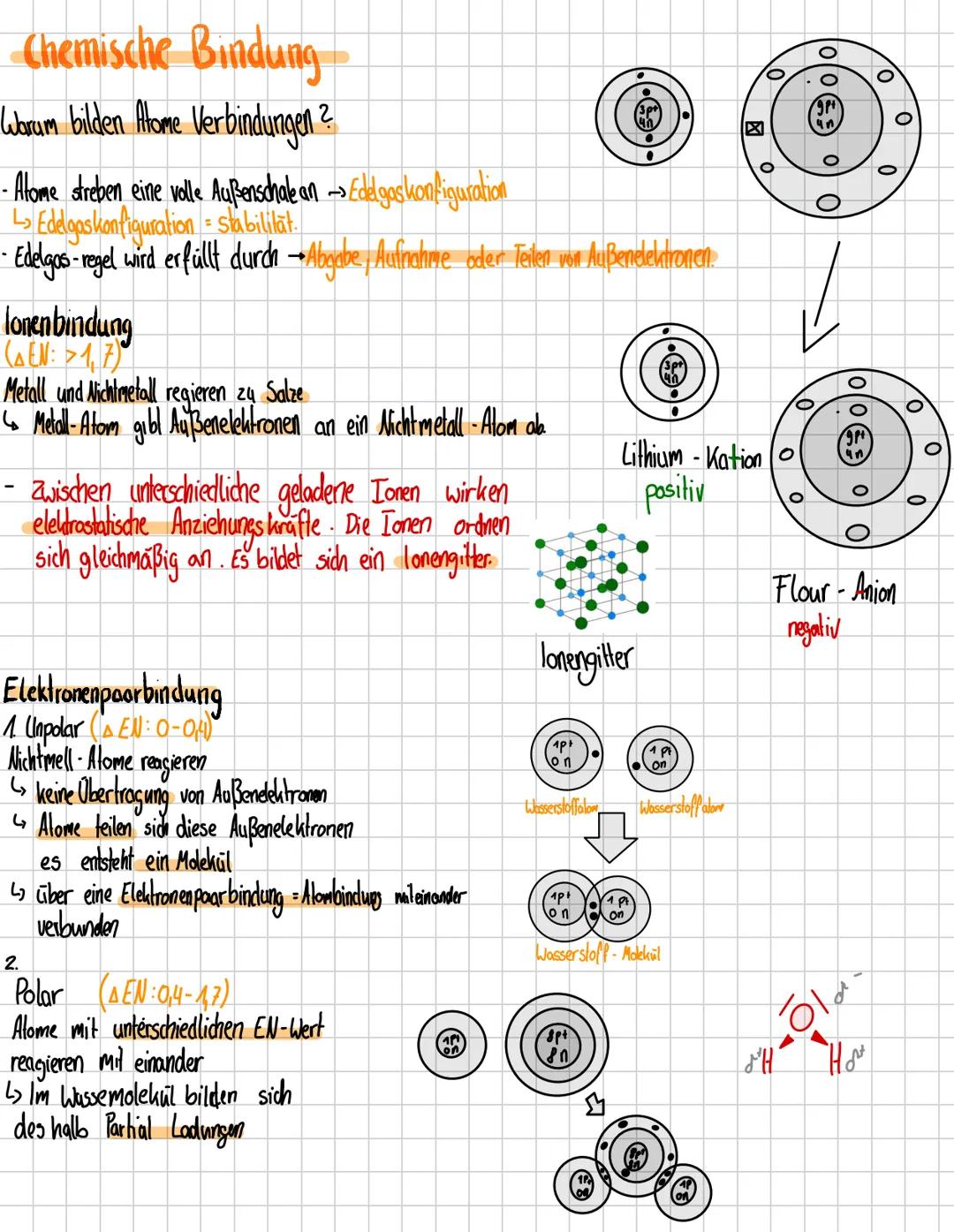
Warum halten Atome überhaupt zusammen? Ganz einfach: Sie wollen alle eine volle Außenschale haben, genau wie die Edelgase. Dafür geben sie Elektronen ab, nehmen welche auf oder teilen sie sich.
Bei der Ionenbindung (ΔEN ≥ 1,7) tauschen Metalle und Nichtmetalle Elektronen komplett aus. Das Metall wird positiv geladen, das Nichtmetall negativ - und Gegensätze ziehen sich bekanntlich an.
Die Elektronenpaarbindung funktioniert anders: Hier teilen sich Atome die Elektronen. Bei unpolaren Bindungen ΔEN0−0,4 teilen beide Atome fair, bei polaren Bindungen ΔEN0,4−1,7 zieht ein Partner stärker an den Elektronen.
Eselsbrücke: Die Elektronegativitätsdifferenz (ΔEN) verrät dir sofort, welche Bindung vorliegt - je größer der Unterschied, desto ungleicher wird geteilt.