Grundbegriffe der Redoxreaktionen
Stell dir vor, Elektronen sind wie Geschenke, die zwischen Atomen ausgetauscht werden. Bei einer Redoxreaktion passiert genau das - es ist eine Elektronenübergangsreaktion, bei der immer zwei Prozesse gleichzeitig ablaufen.
Die Oxidation ist der Prozess, bei dem ein Stoff Elektronen abgibt (seine Oxidationszahl steigt). Die Reduktion läuft parallel ab - hier nimmt ein anderer Stoff die Elektronen auf (seine Oxidationszahl sinkt). Ohne Oxidation keine Reduktion und umgekehrt!
Oxidationsmittel sind die "Elektronenräuber" - sie sorgen dafür, dass andere Stoffe oxidiert werden, werden dabei aber selbst reduziert. Reduktionsmittel machen das Gegenteil: Sie reduzieren andere Stoffe und werden selbst oxidiert.
💡 Merkhilfe: OIL RIG - Oxidation Is Loss (of electrons), Reduction Is Gain (of electrons)
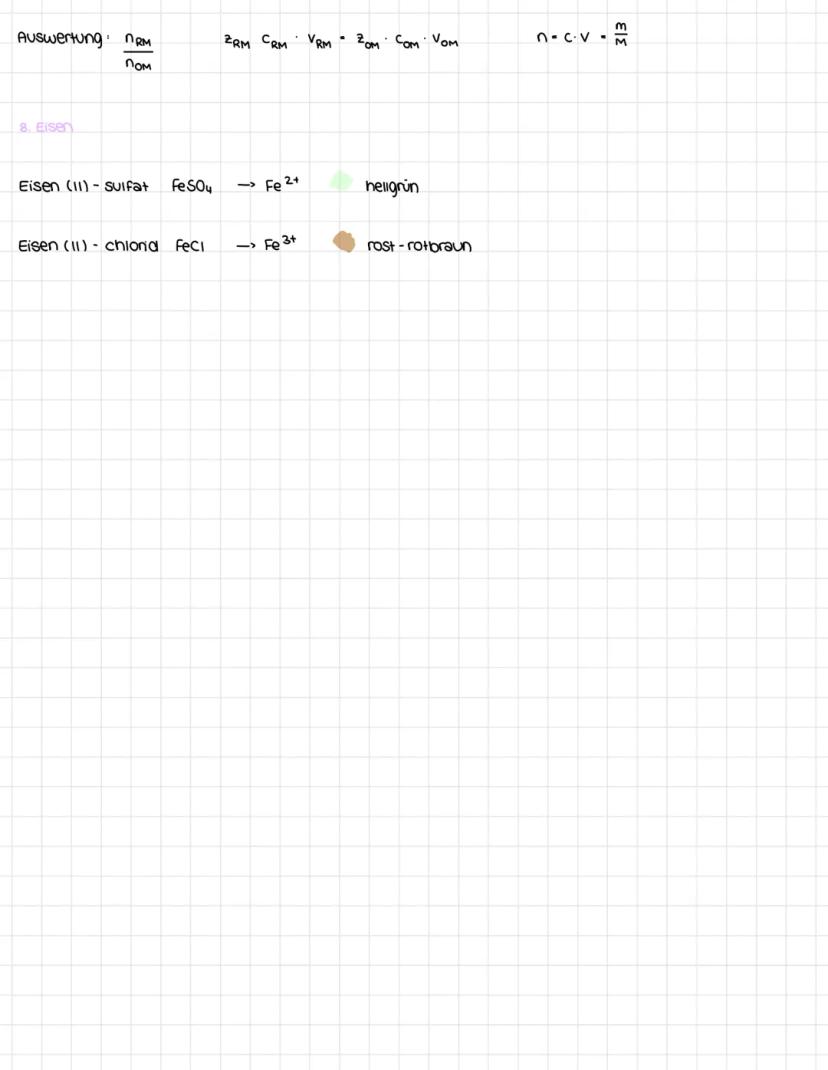
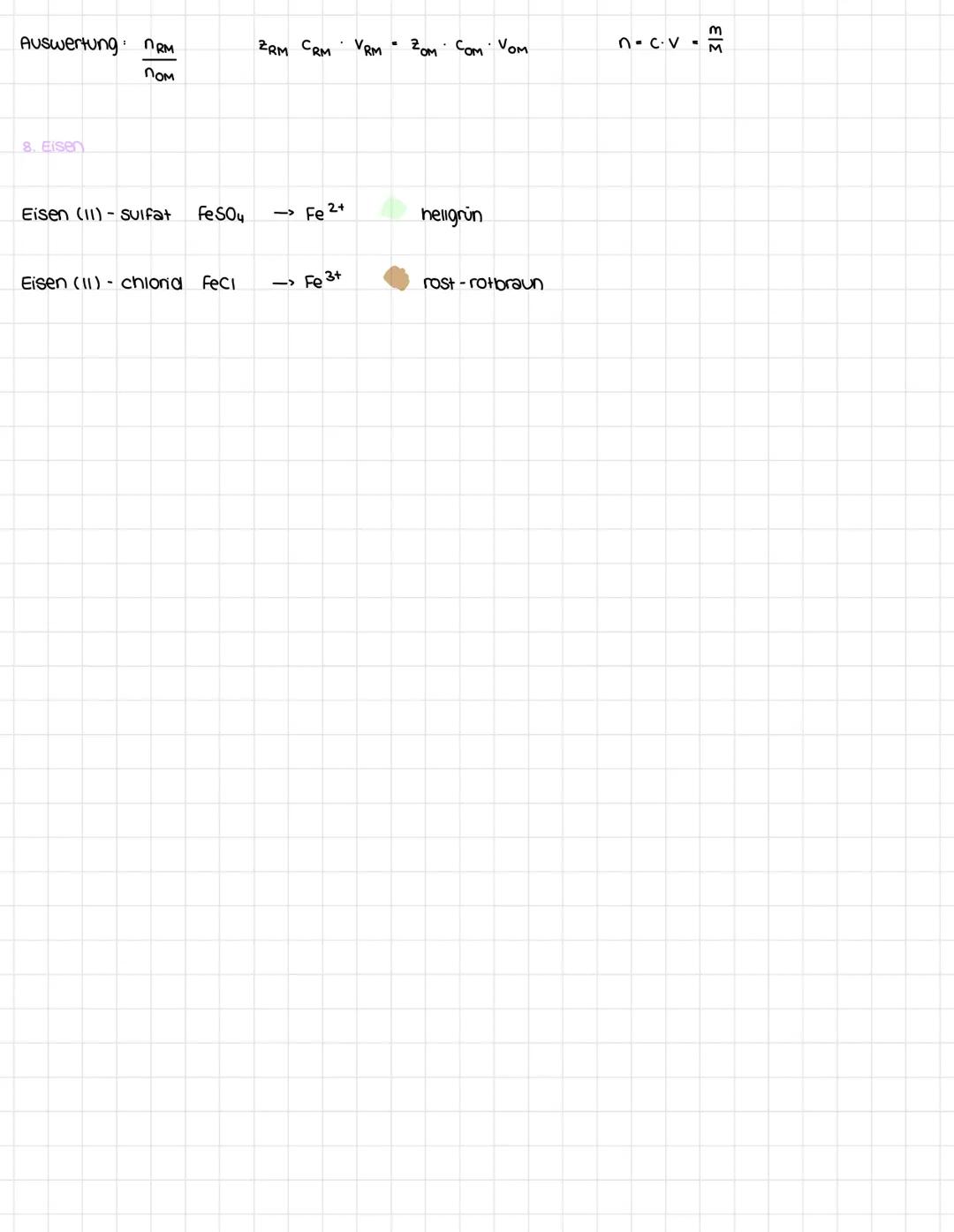
Korrespondierende Redoxpaare sind wie Tanzpartner - sie gehören zusammen und können durch Elektronenaufnahme oder -abgabe ineinander umgewandelt werden. Oxidationszahlen helfen dir dabei, den Überblick zu behalten - sie zeigen die fiktive Ladung jedes Atoms in einer Verbindung.