Titrationstechniken und Berechnungen
Verschiedene Titrationsarten bieten unterschiedliche Vorteile: Endpunktbestimmung mit Indikator ist schnell, pH-metrische Titration genauer, Leitfähigkeitstitration funktioniert auch bei schwachen Säuren/Basen super.
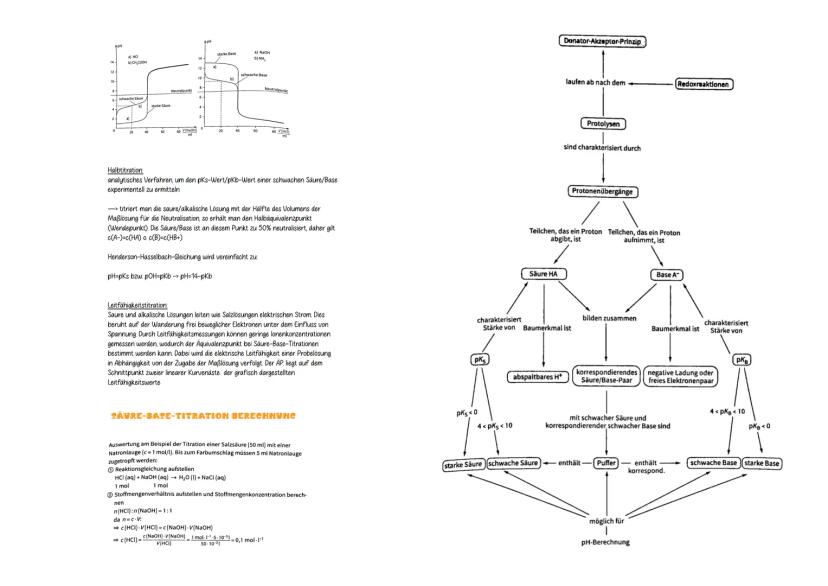
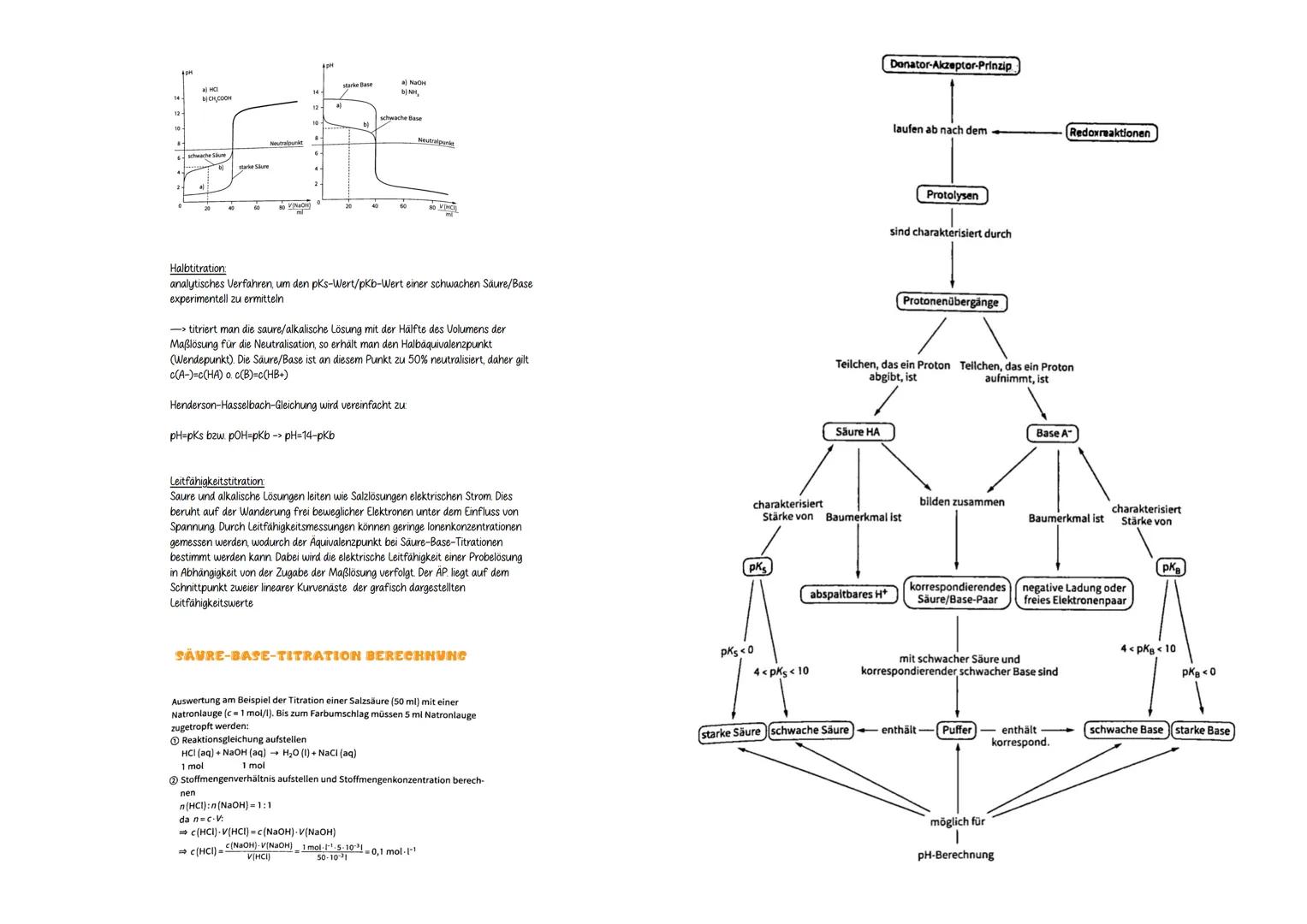
Halbtitration ist genial für pK-Bestimmungen: Bei 50% Neutralisation gilt c(A⁻) = c(HA), also pH = pK_s. Der Äquivalenzpunkt liegt nur bei starken Säuren/Basen beim Neutralpunkt (pH 7).
Berechnungsbeispiel: 50 ml HCl brauchen 5 ml NaOH 1mol/l bis zum Farbumschlag. Mit n(HCl) = n(NaOH) und c·V = c·V folgt: c(HCl) = 1mol/l⋅5ml / 50 ml = 0,1 mol/l.
Die Titrationskurve verrät viel: Starke Säuren zeigen steile pH-Sprünge, schwache flachere Verläufe mit zwei charakteristischen Wendepunkten. Je nach Probelösung verschiebt sich der Äquivalenzpunkt ins Saure oder Alkalische.
💡 Wichtig: Nur wenige Tropfen Indikator verwenden – er reagiert selbst als Säure/Base und verfälscht sonst das Ergebnis!