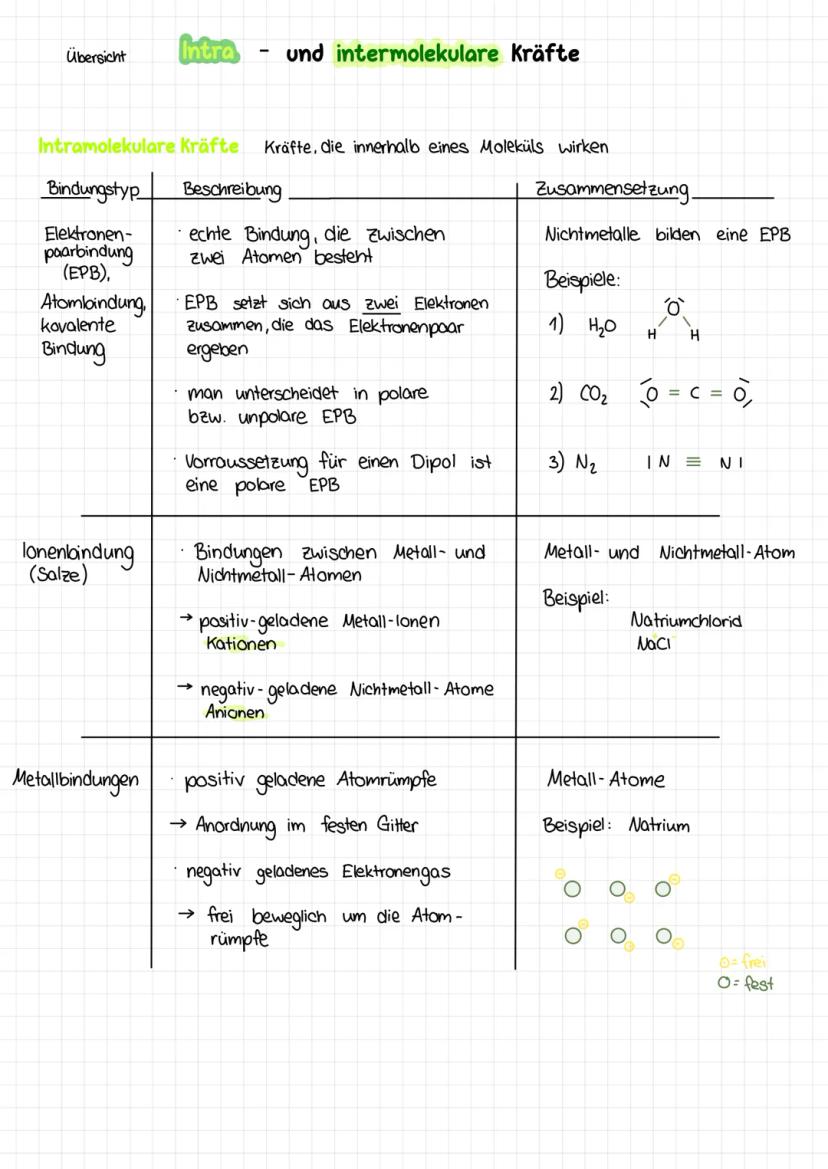
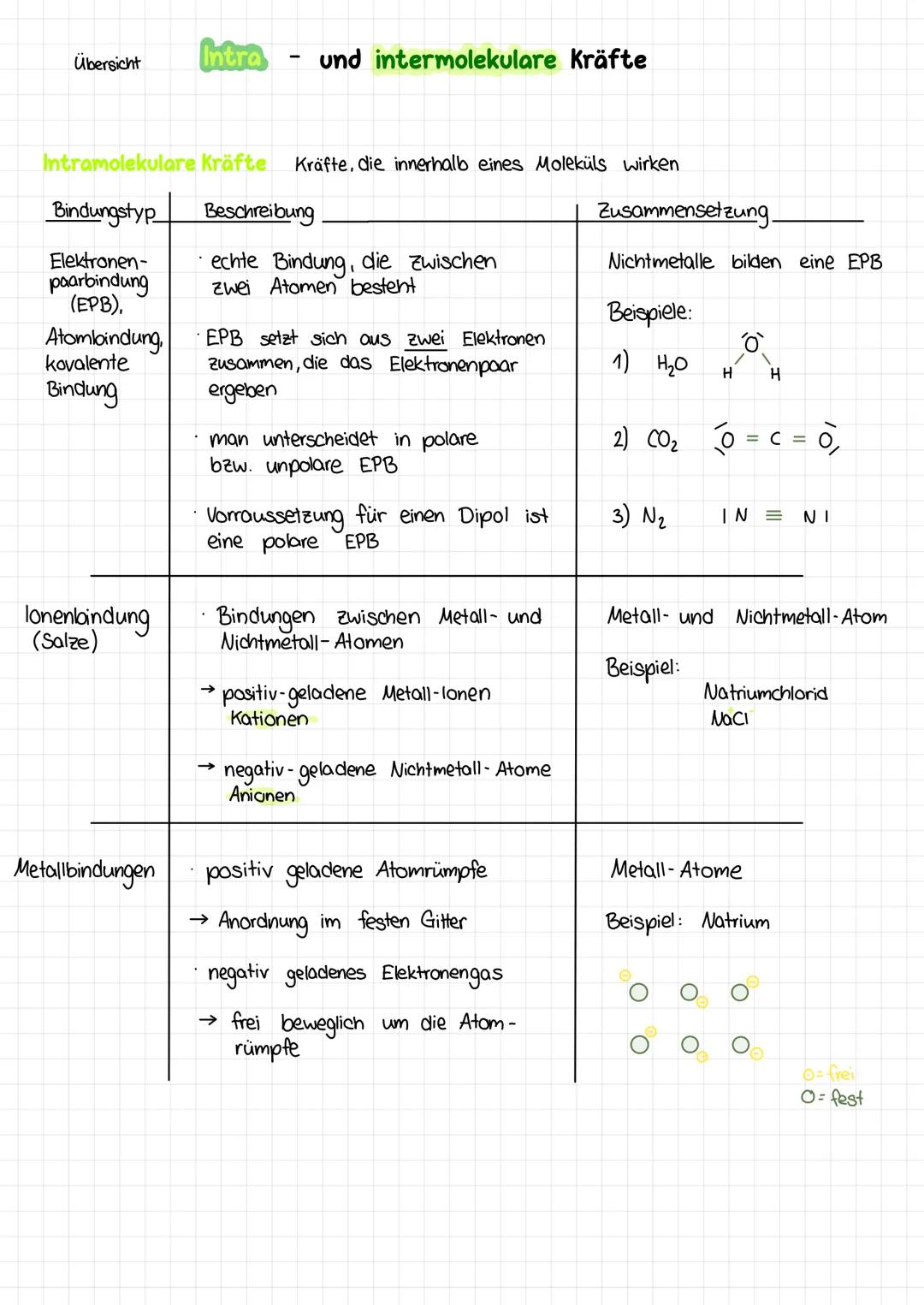
Ion-Dipol-Wechselwirkungen - Wenn sich Gegensätze anziehen
Hier treffen zwei Welten aufeinander: Ionen (geladene Teilchen) und Dipole (polare Moleküle). Das passiert zum Beispiel, wenn du Salz in Wasser löst!
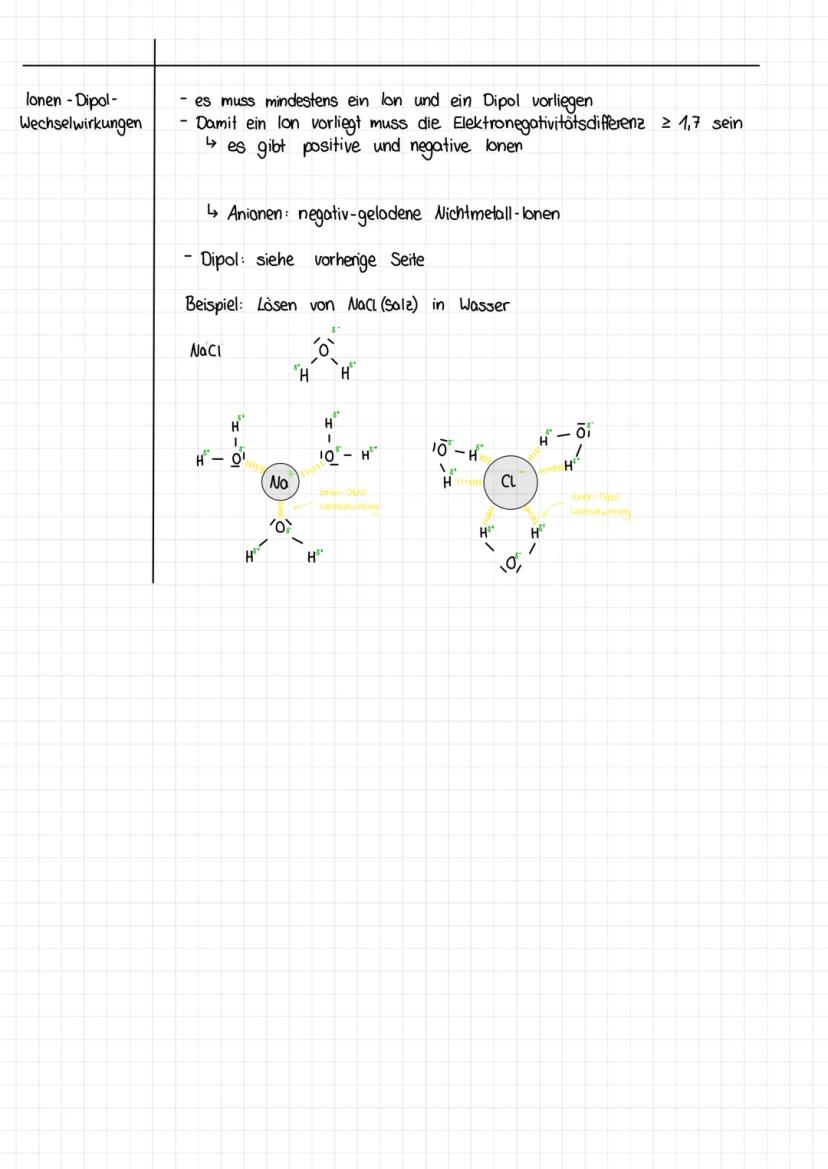
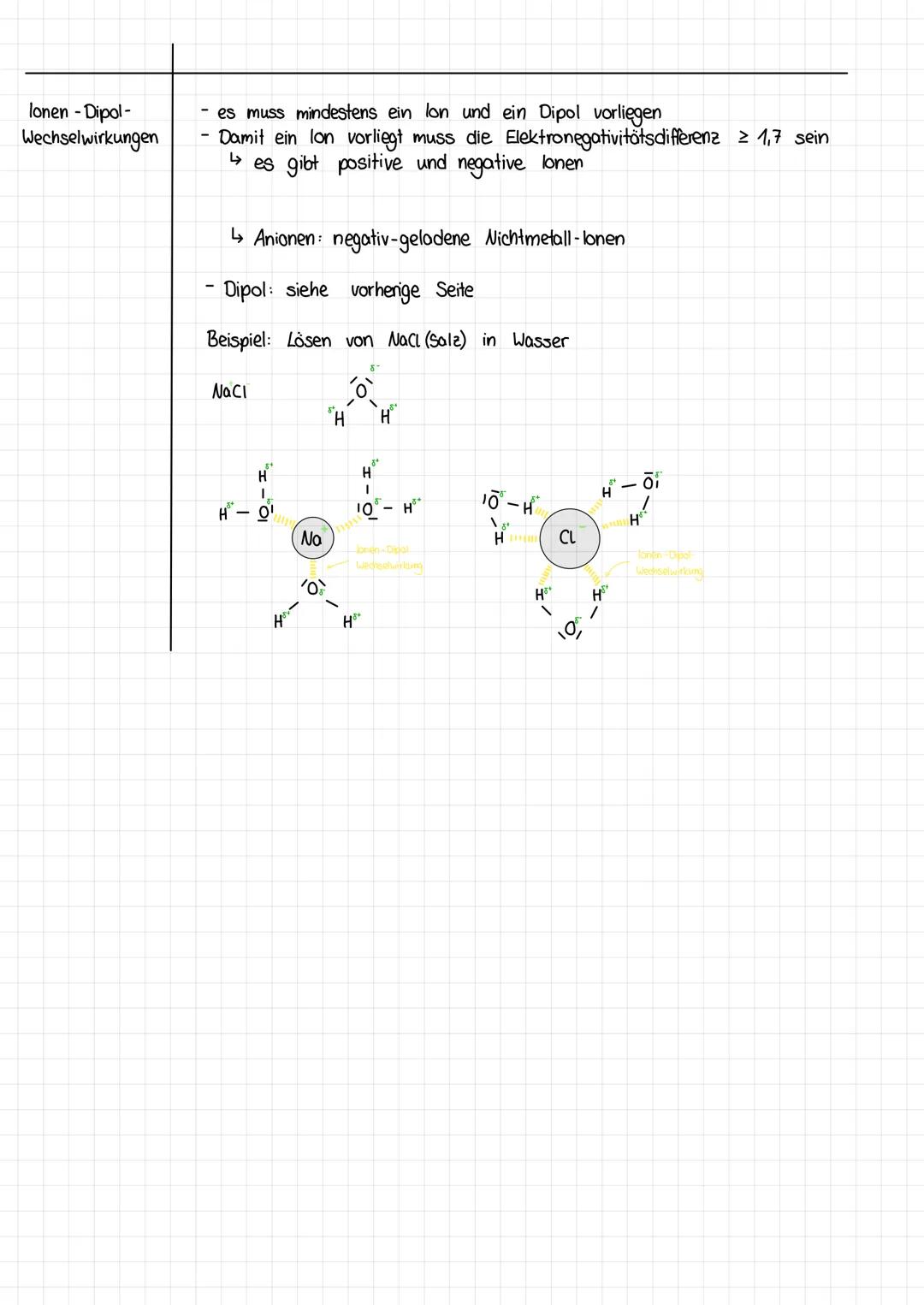
Damit Ionen entstehen, muss die Elektronegativitätsdifferenz mindestens 1,7 betragen. So entstehen Kationen (positive Metallionen) und Anionen (negative Nichtmetallionen).
Beim Lösen von NaCl umgeben die Wassermoleküle die Ionen: Die negativen Sauerstoffatome orientieren sich zum Na⁺-Ion, die positiven Wasserstoffatome zum Cl⁻-Ion. Diese Hydratation erklärt, warum sich Salz so gut in Wasser löst.
Die Stärke dieser Wechselwirkungen hängt von der Ladung des Ions und der Polarität des Dipols ab. Je größer beide sind, desto stärker die Anziehung!
Praxistipp: Ion-Dipol-Wechselwirkungen erklären fast alle Lösungsvorgänge in der Chemie - verstehst du sie, verstehst du Löslichkeit!