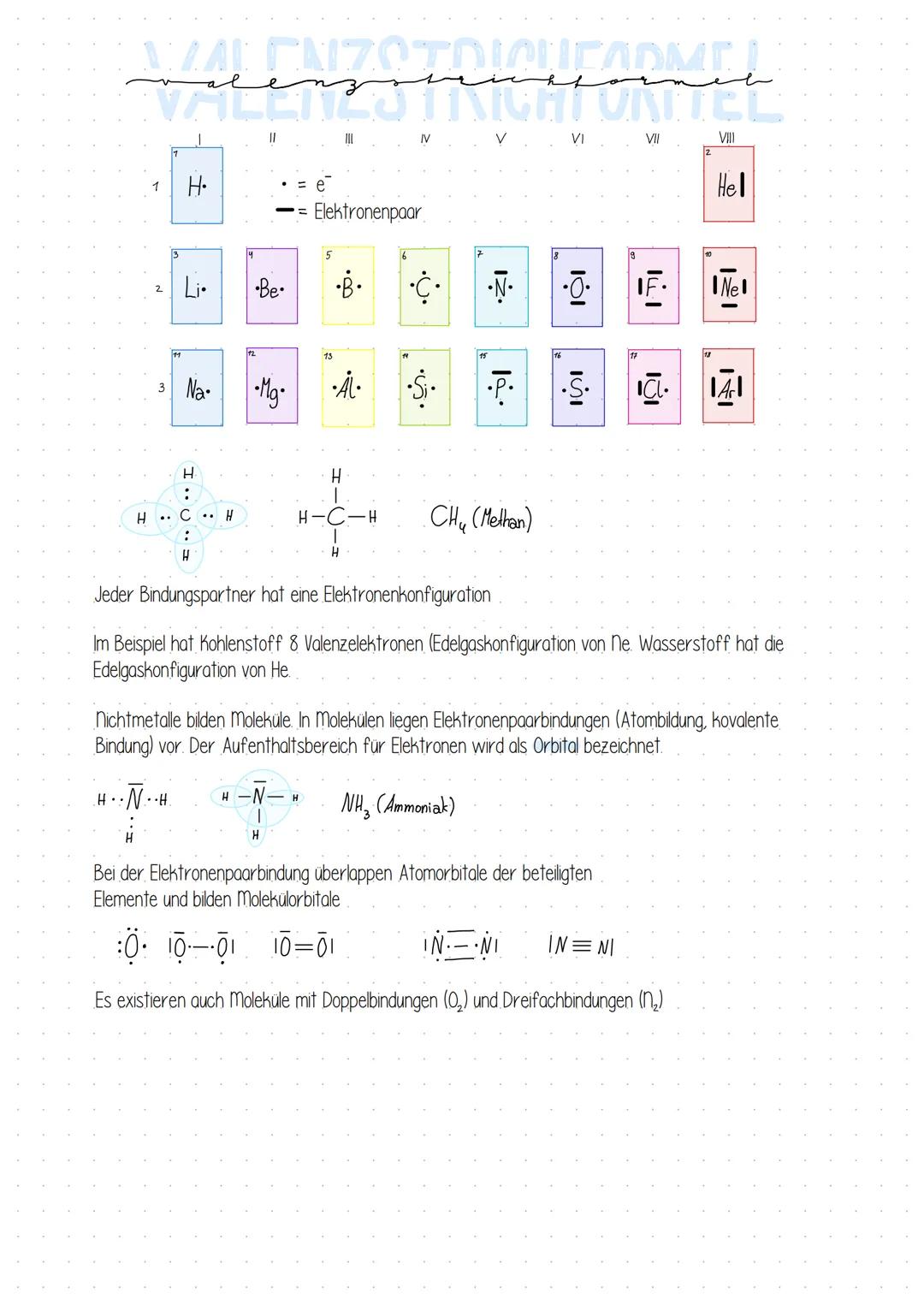
Elektronenpaarbindung - Wie Atome ihre Elektronen teilen
Du kennst bestimmt Methan (CH₄) - das Gas, das beim Kochen verwendet wird. Hier siehst du perfekt, wie eine Elektronenpaarbindung funktioniert! Ein Kohlenstoffatom teilt sich mit vier Wasserstoffatomen jeweils ein Elektronenpaar.
Das Coole daran: Jedes Atom bekommt dadurch eine Edelgaskonfiguration. Der Kohlenstoff hat dann 8 Valenzelektronen (wie Neon) und jeder Wasserstoff 2 Elektronen (wie Helium). Alle sind zufrieden!
Diese Art der Bindung findest du nur bei Nichtmetallen. Sie bilden zusammen Moleküle, indem ihre Atomorbitale überlappen und neue Molekülorbitale entstehen.
Merktipp: Bei Ammoniak (NH₃) macht Stickstoff dasselbe - er teilt seine Elektronen mit drei Wasserstoffatomen und alle erreichen die Edelgaskonfiguration!
Manche Atome sind besonders "hungrig" nach Elektronen und bilden Doppelbindungen (wie O₂) oder sogar Dreifachbindungen (wie N₂). Je mehr Bindungen, desto stärker halten die Atome zusammen!