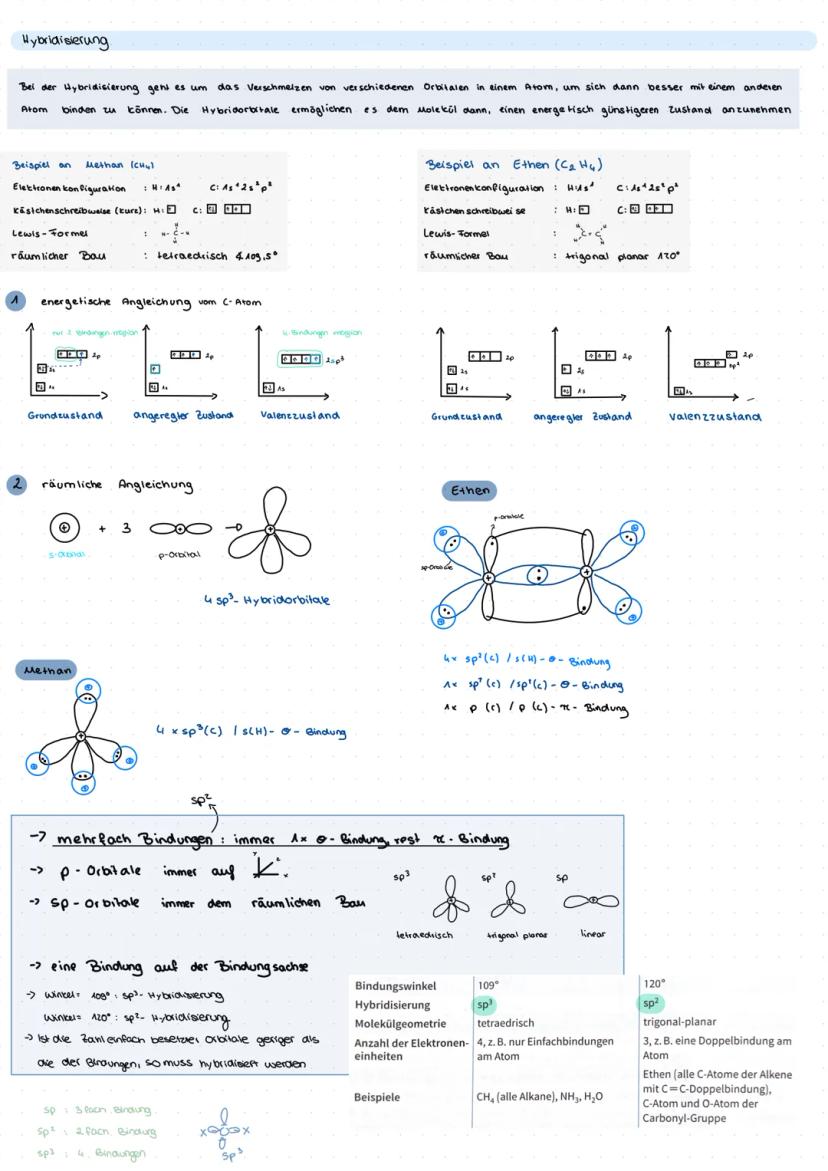
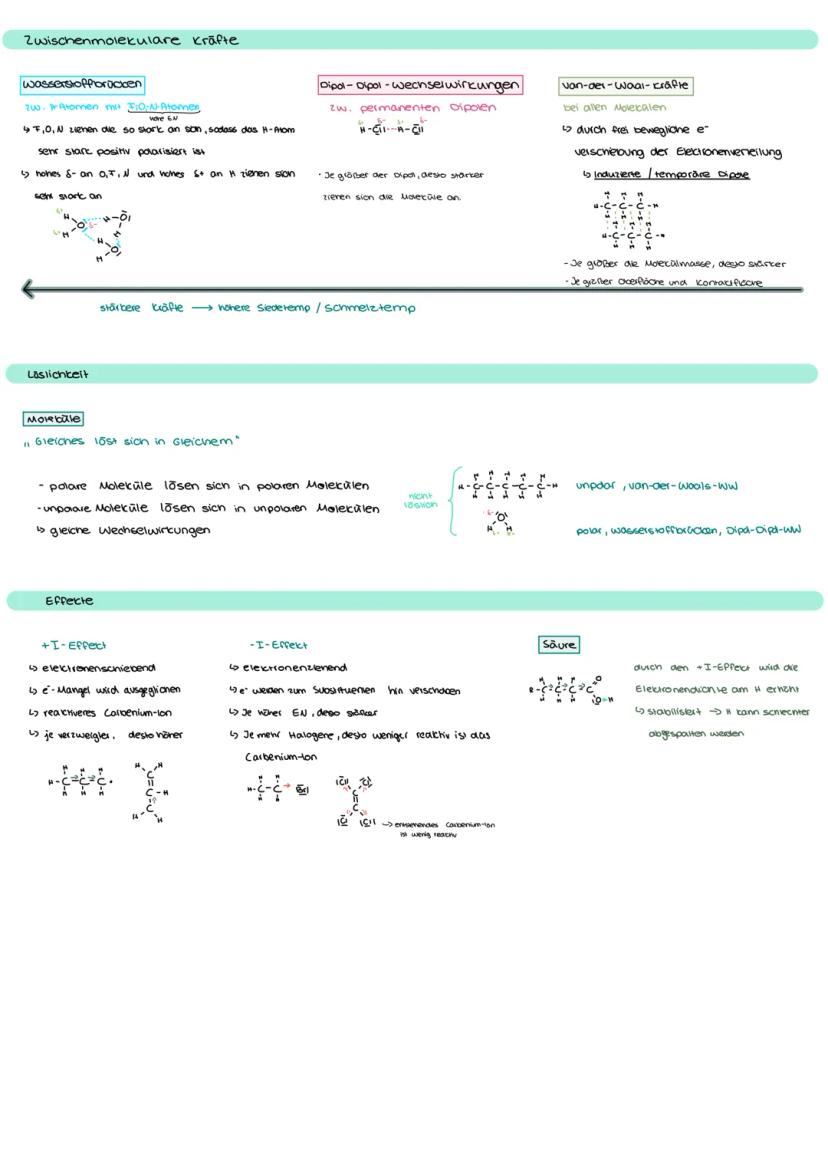
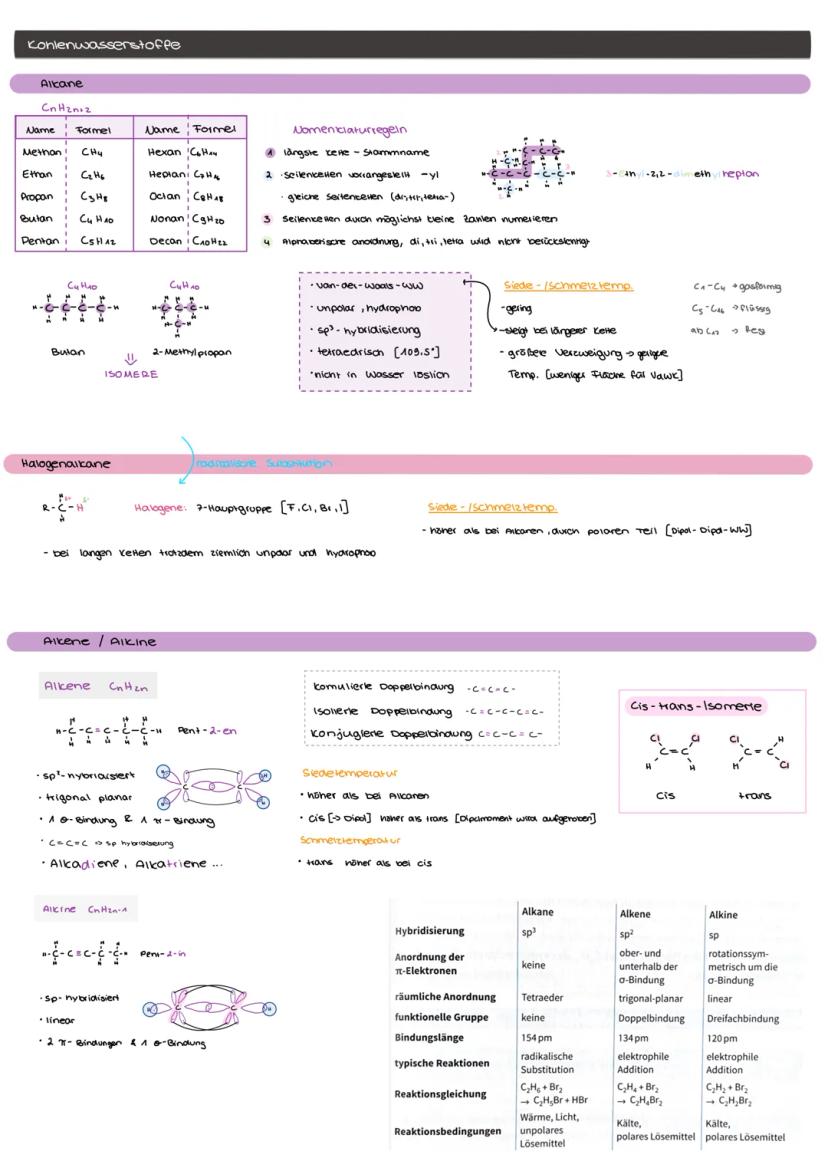
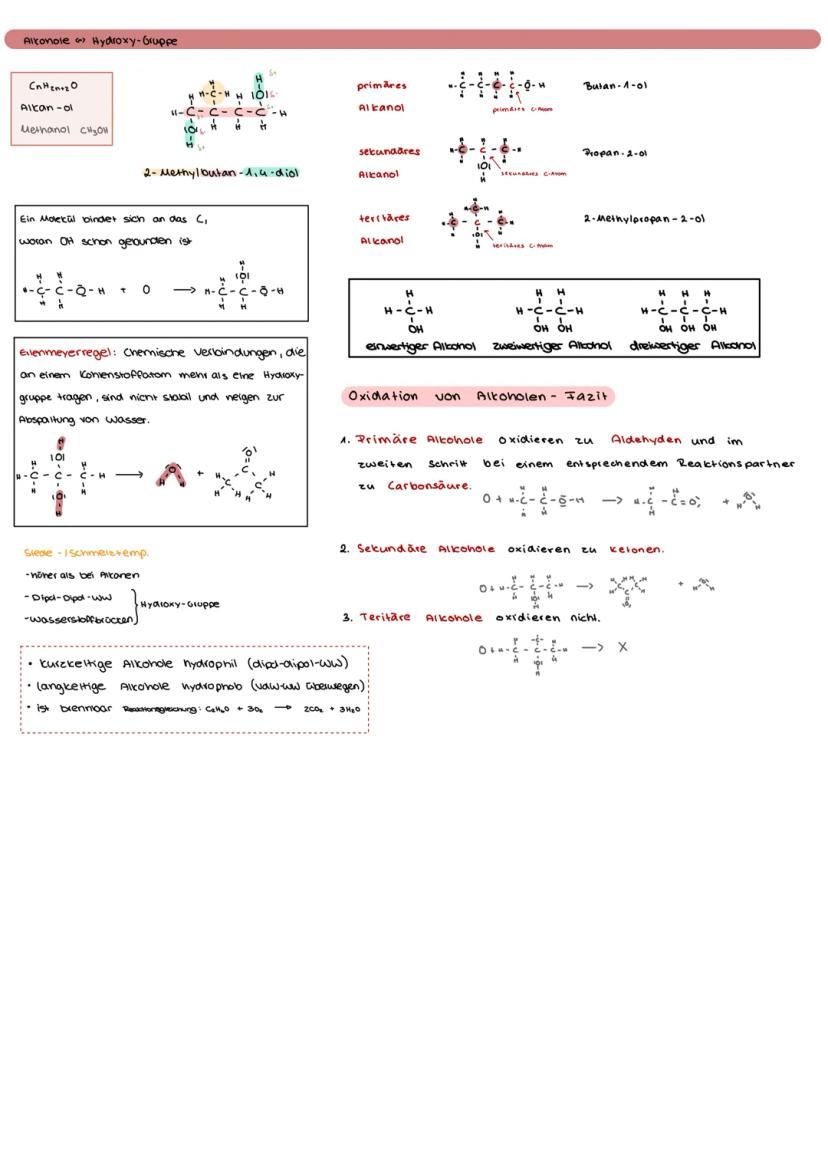
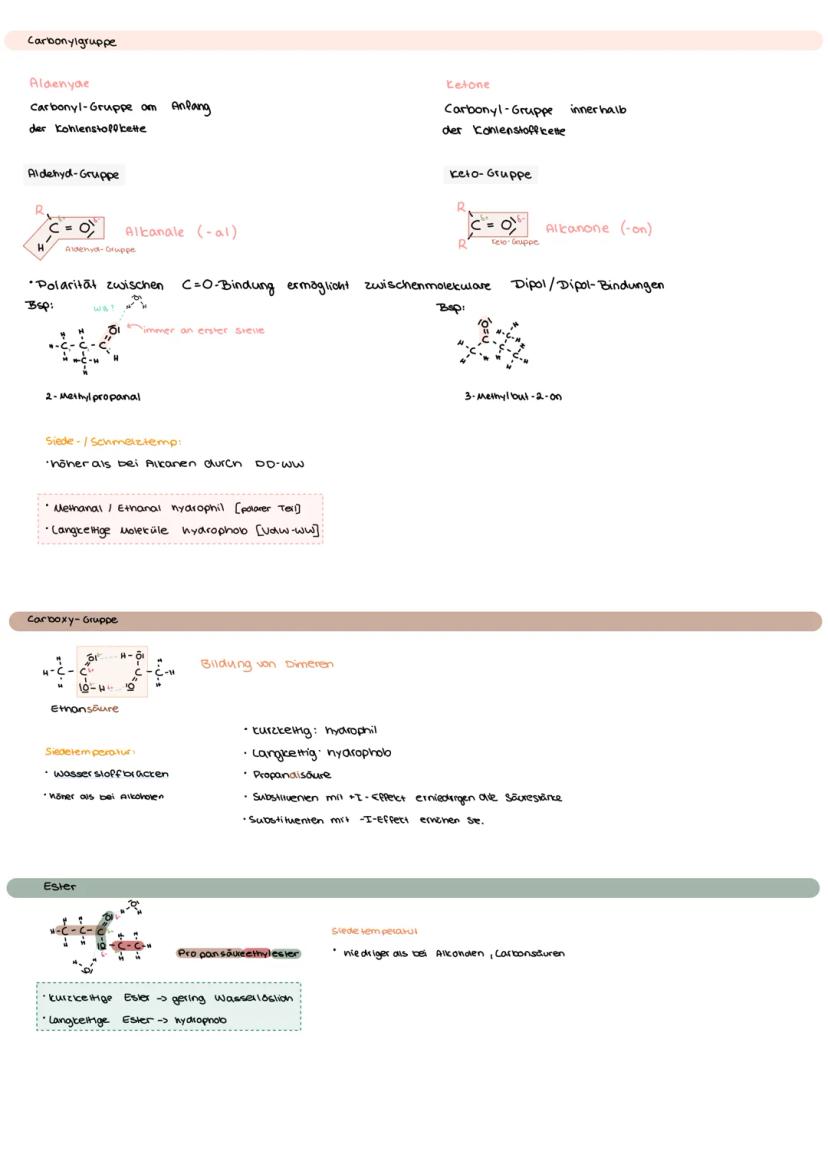
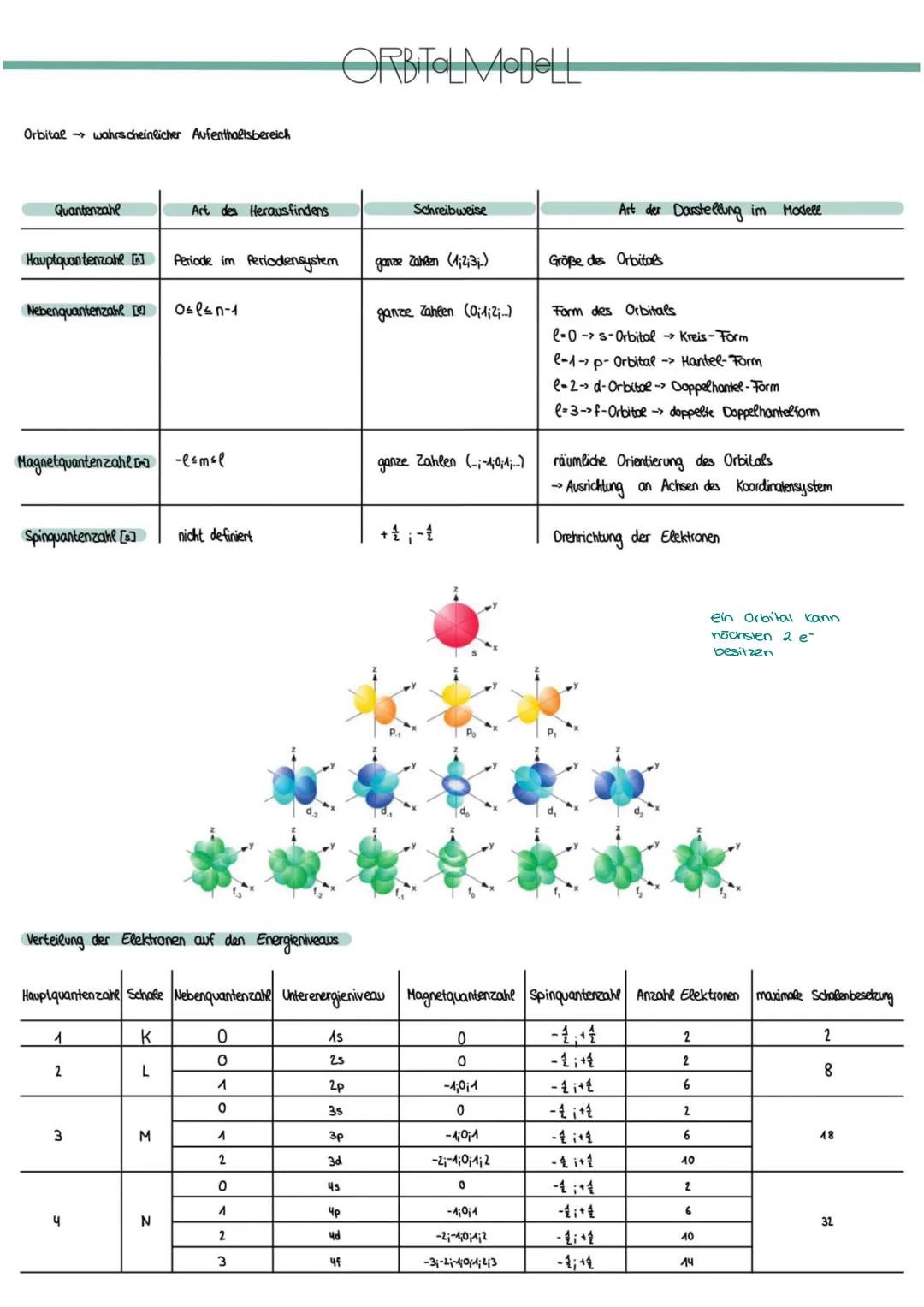
Atommodelle - Die Grundlagen verstehen
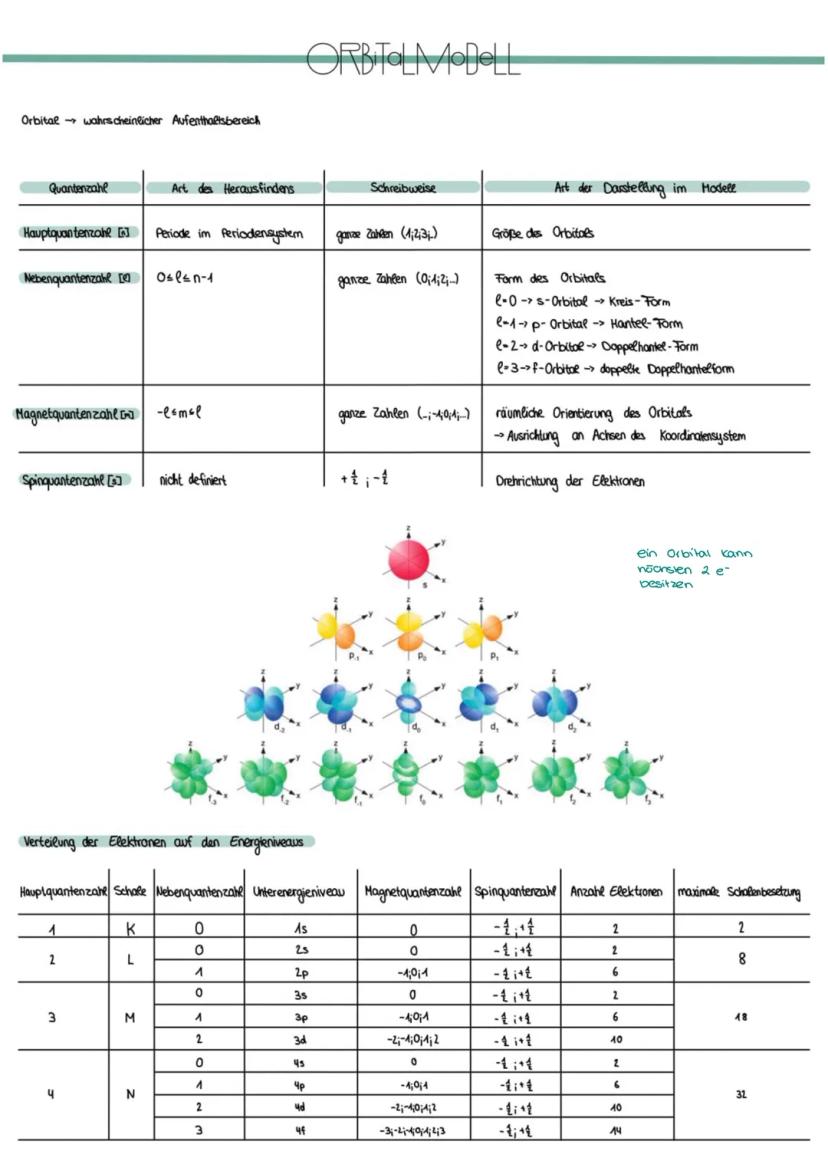
Das Schalenmodell zeigt dir, wo sich Elektronen aufhalten. Die Formel 2n² verrät dir, wie viele Elektronen maximal in eine Schale passen: K-Schale (2 Elektronen), L-Schale (8 Elektronen), M-Schale (18 Elektronen) und so weiter. Das ist wie ein Apartment-Gebäude mit verschiedenen Stockwerken.
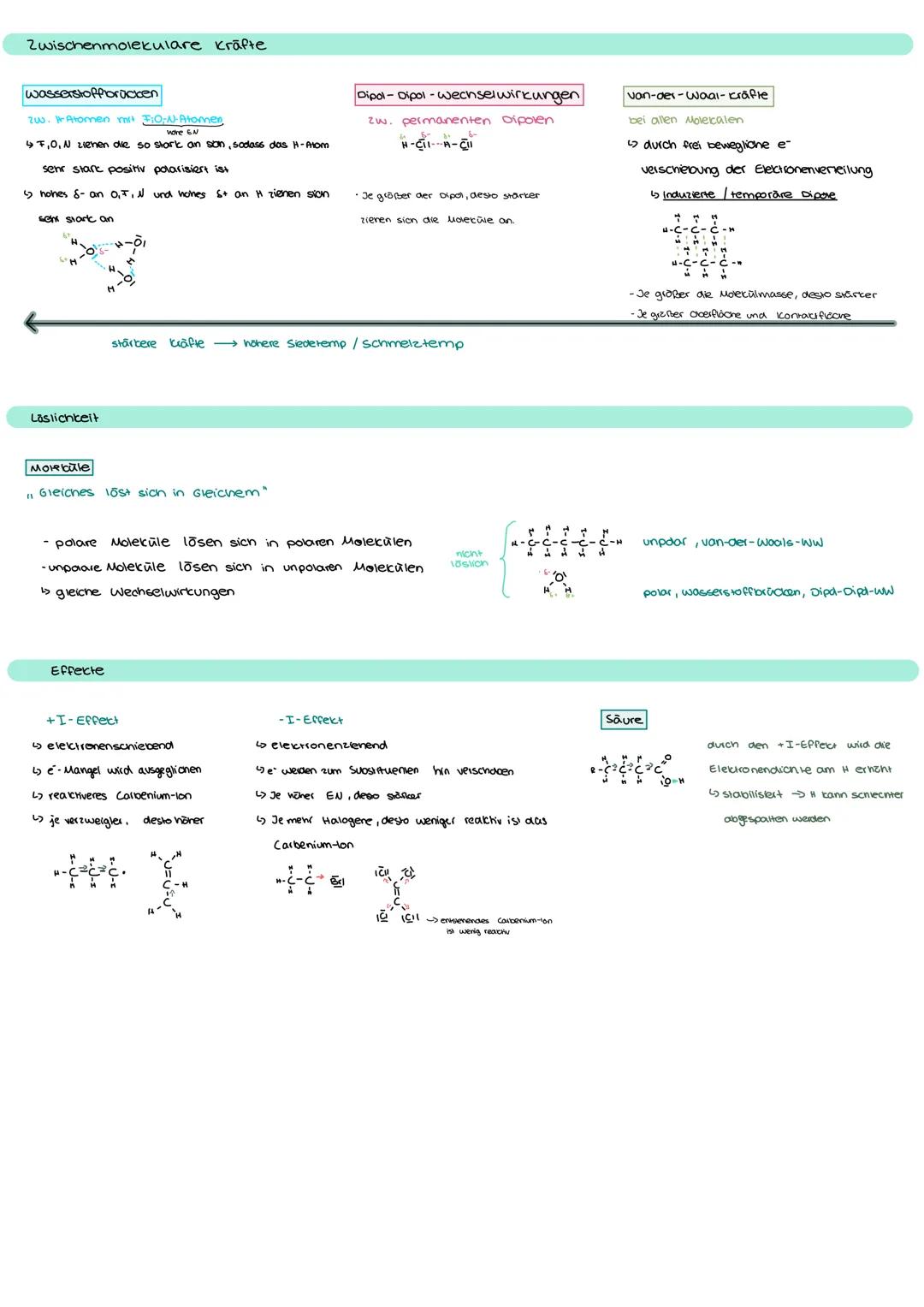
Beim Energiestufenmodell haben Elektronen verschiedene Energielevel. Je weiter außen, desto mehr Energie besitzen sie. Das erklärt, warum äußere Elektronen leichter abgegeben werden können.
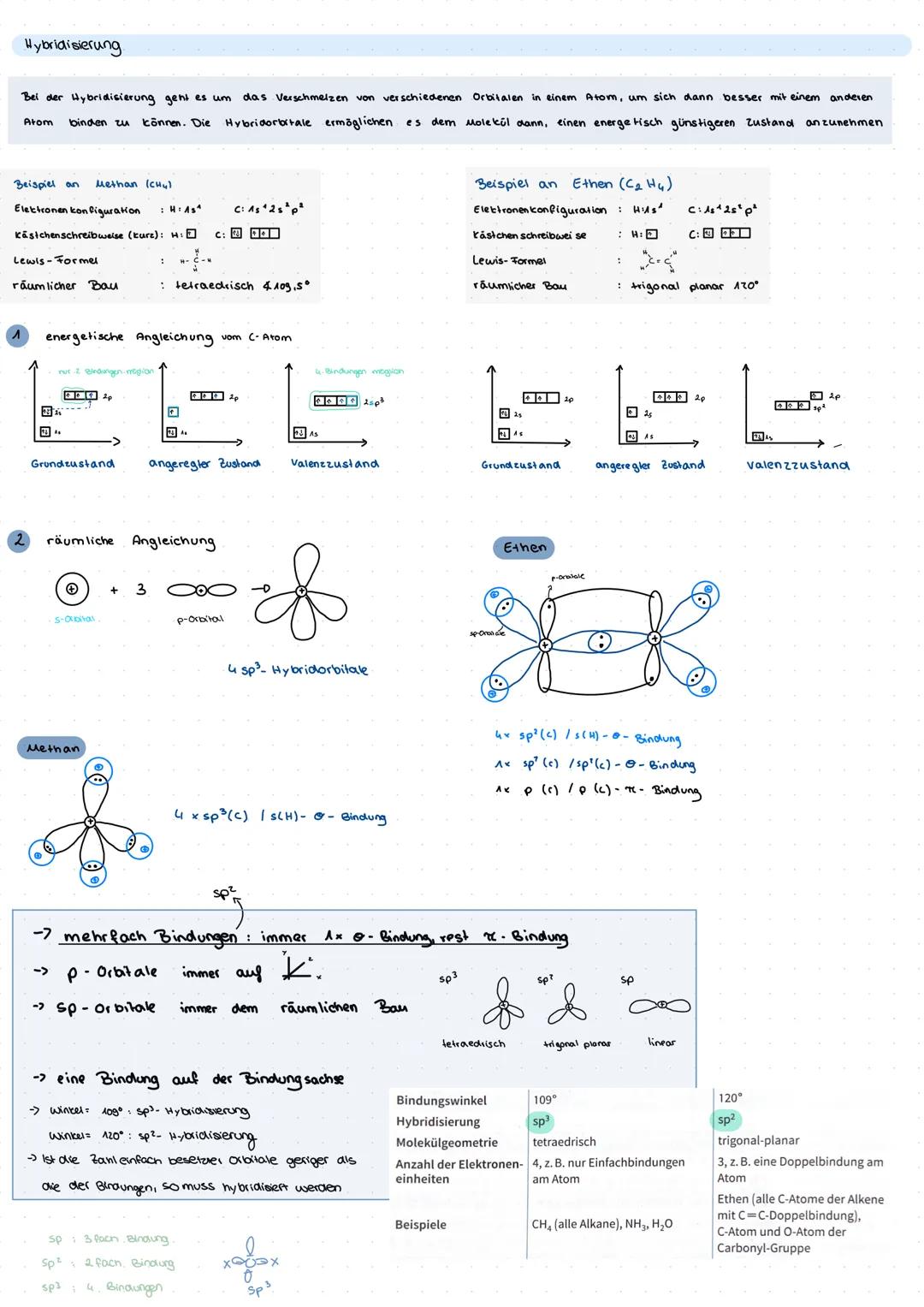
Die Elektronenbesetzung folgt einer bestimmten Reihenfolge: erst s-Orbitale, dann p-, d- und f-Orbitale. Chlor schreibst du als 1s² 2s² 2p⁶ 3s² 3p⁵. Das sieht kompliziert aus, folgt aber einfachen Regeln.
Merktipp: Die Kastchenschreibweise hilft dir dabei, die Orbital-Reihenfolge zu visualisieren und Elektronenkonfigurationen schnell zu bestimmen.
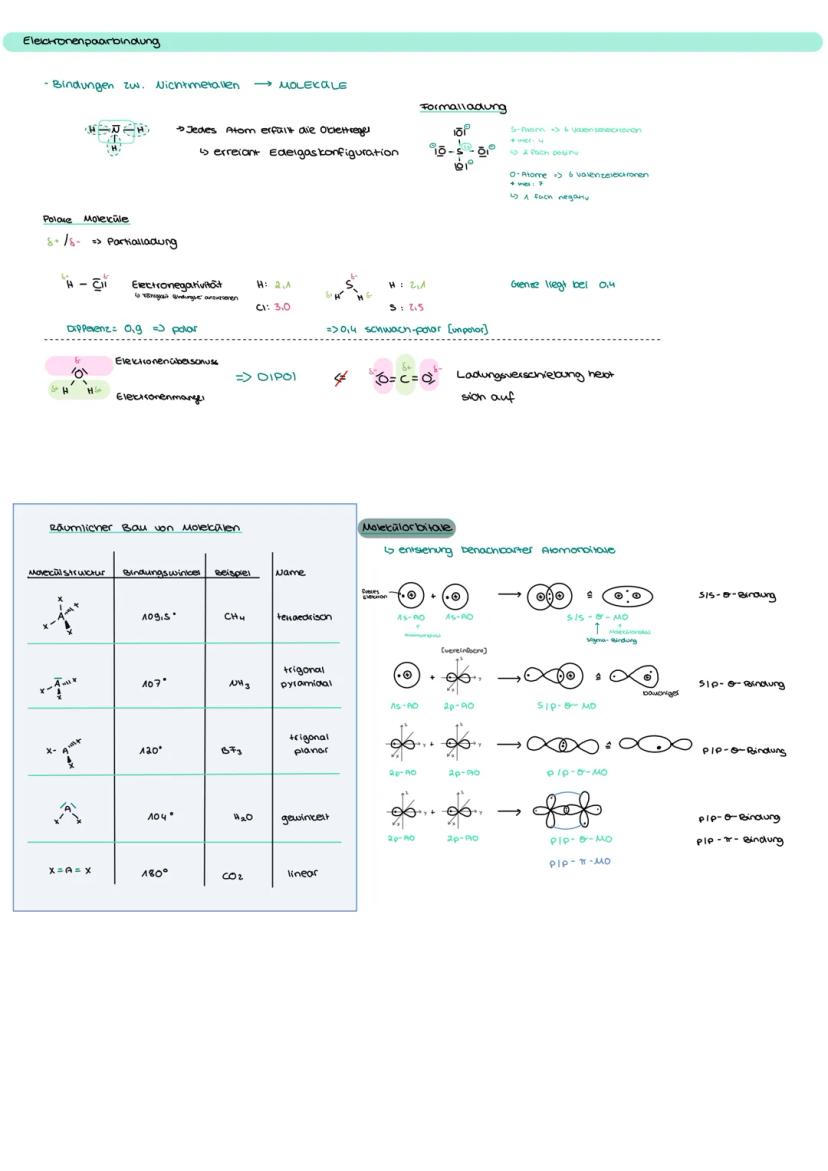
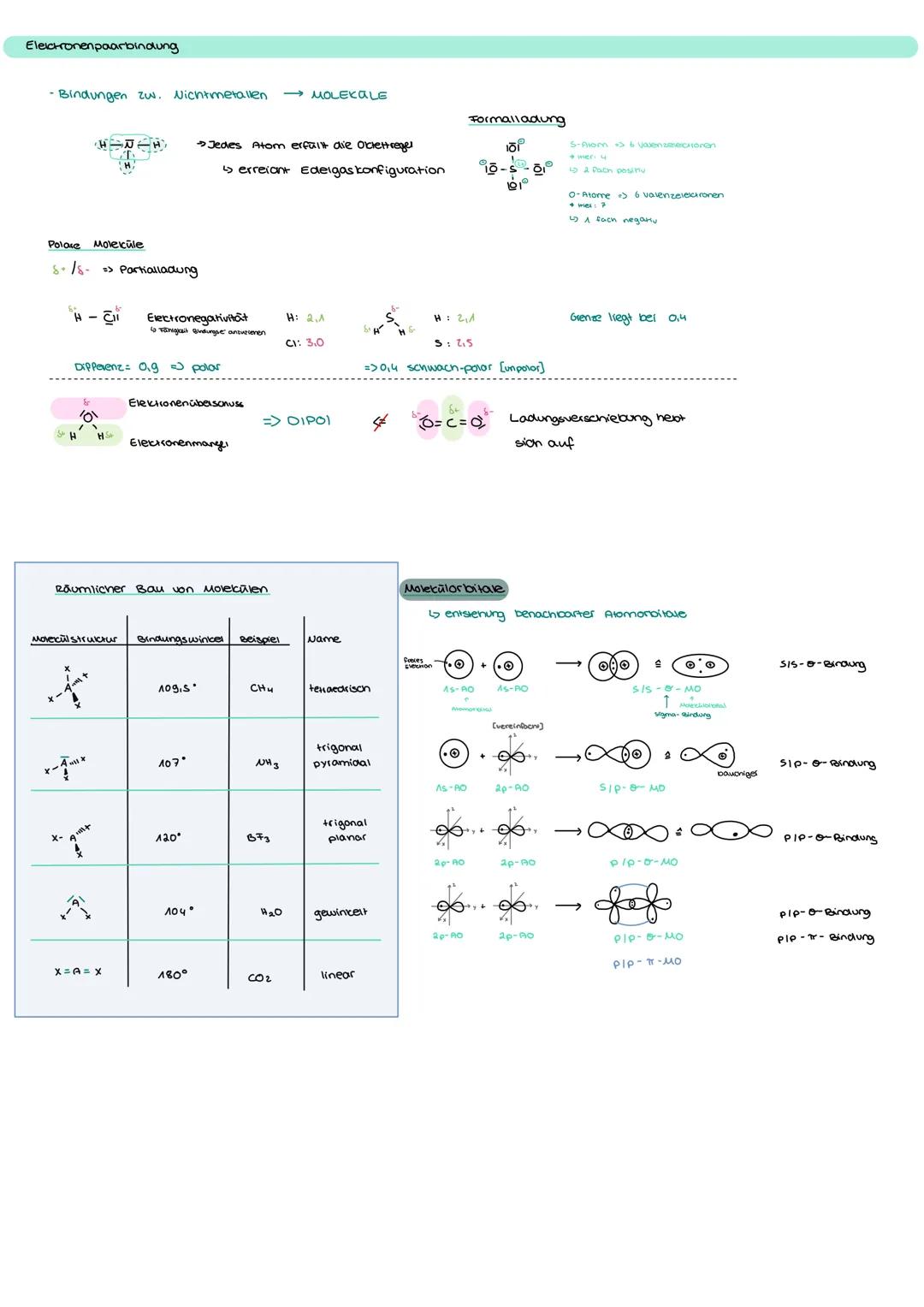
Bei Lewisformeln zeichnest du Bindungen als Striche und freie Elektronenpaare als Punkte. Partialladungen δ+undδ− entstehen, wenn Atome unterschiedlich stark an Elektronen ziehen.