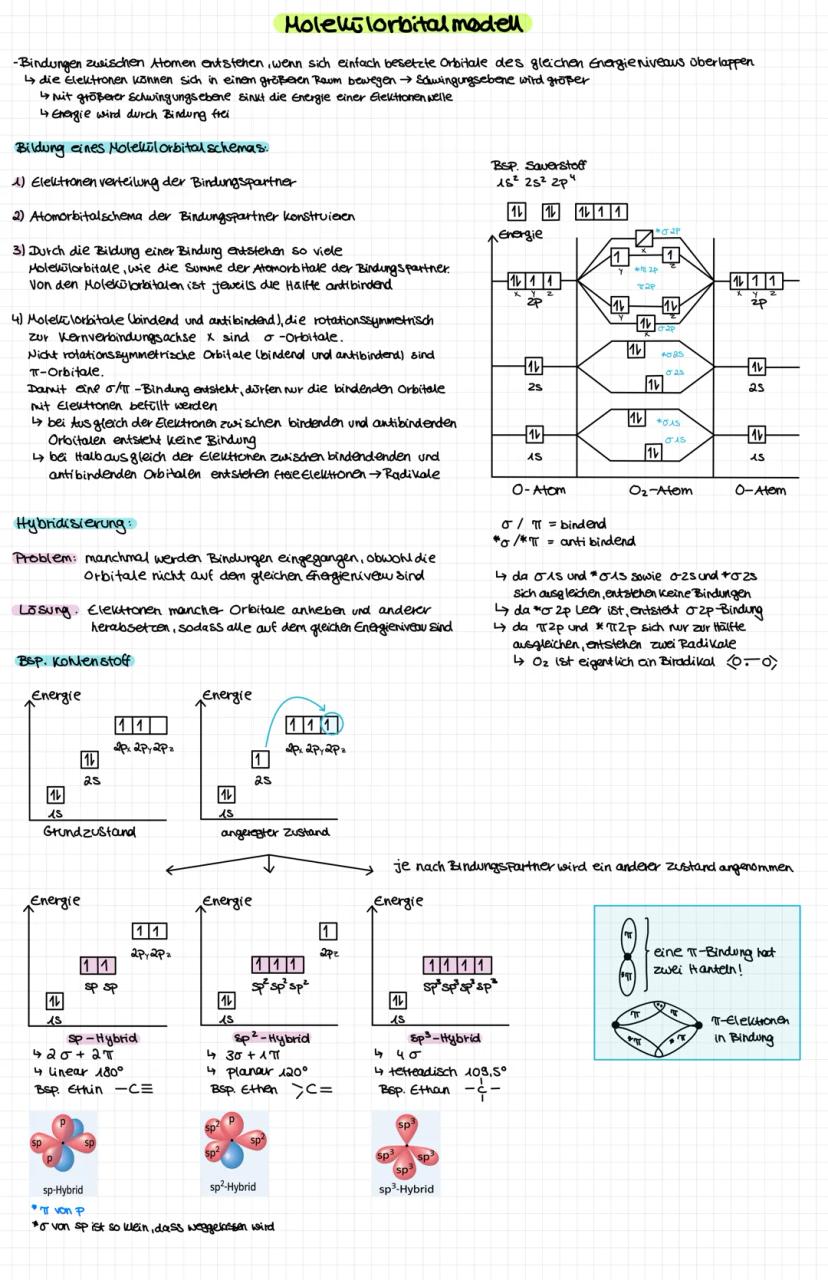
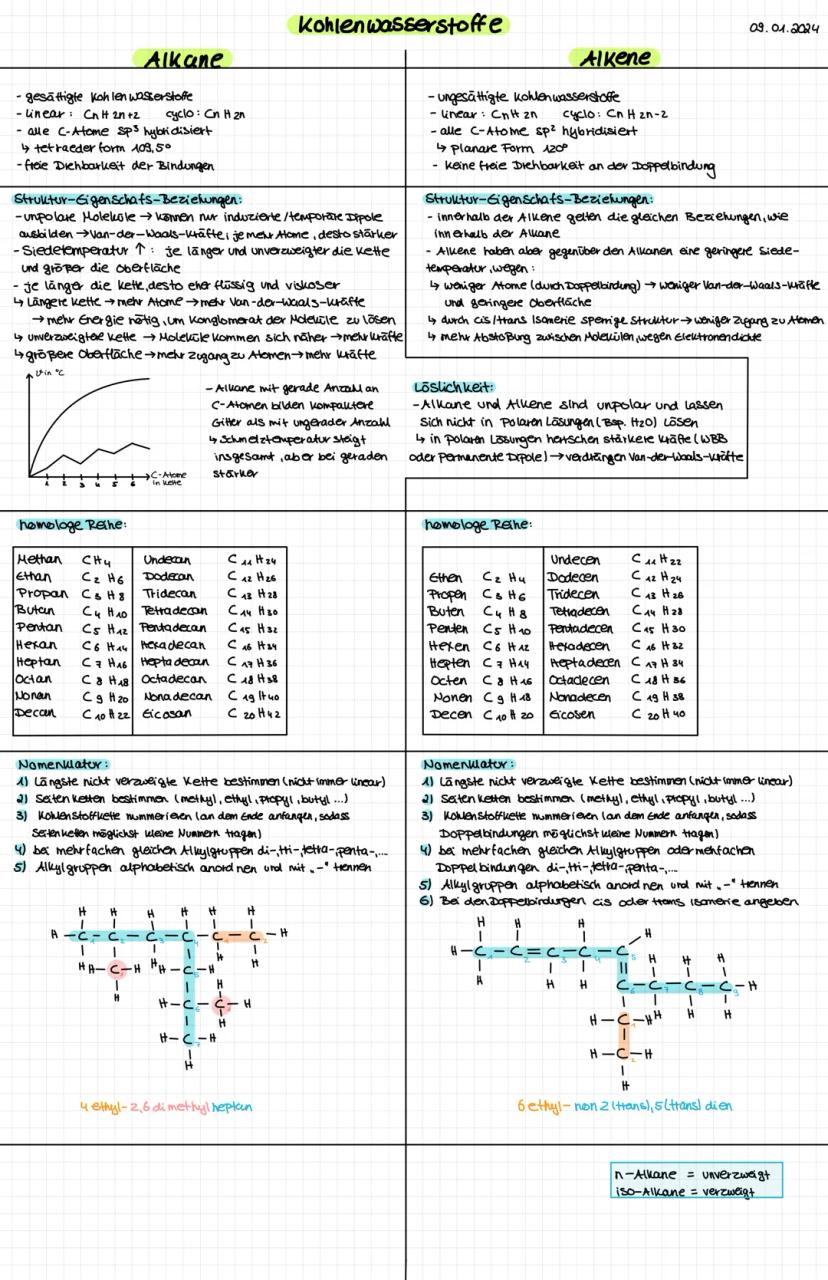
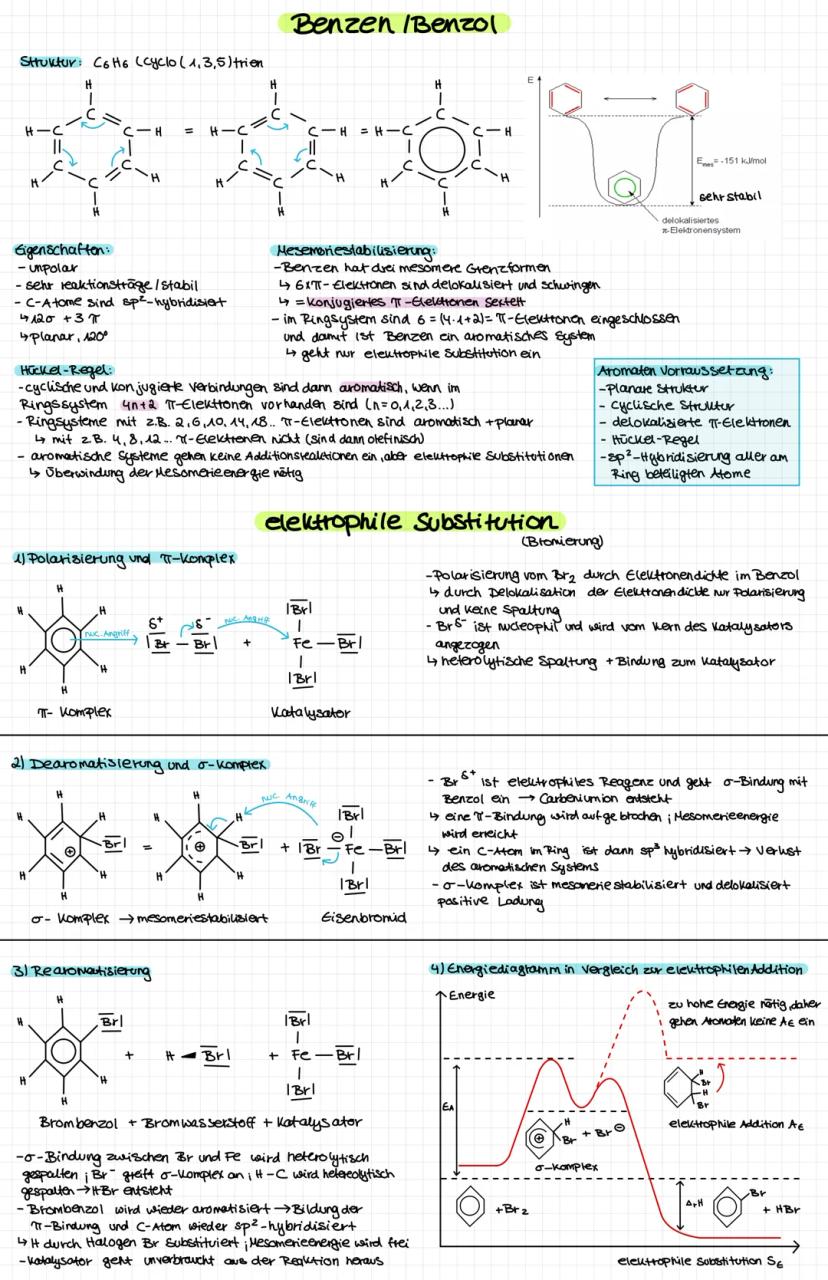
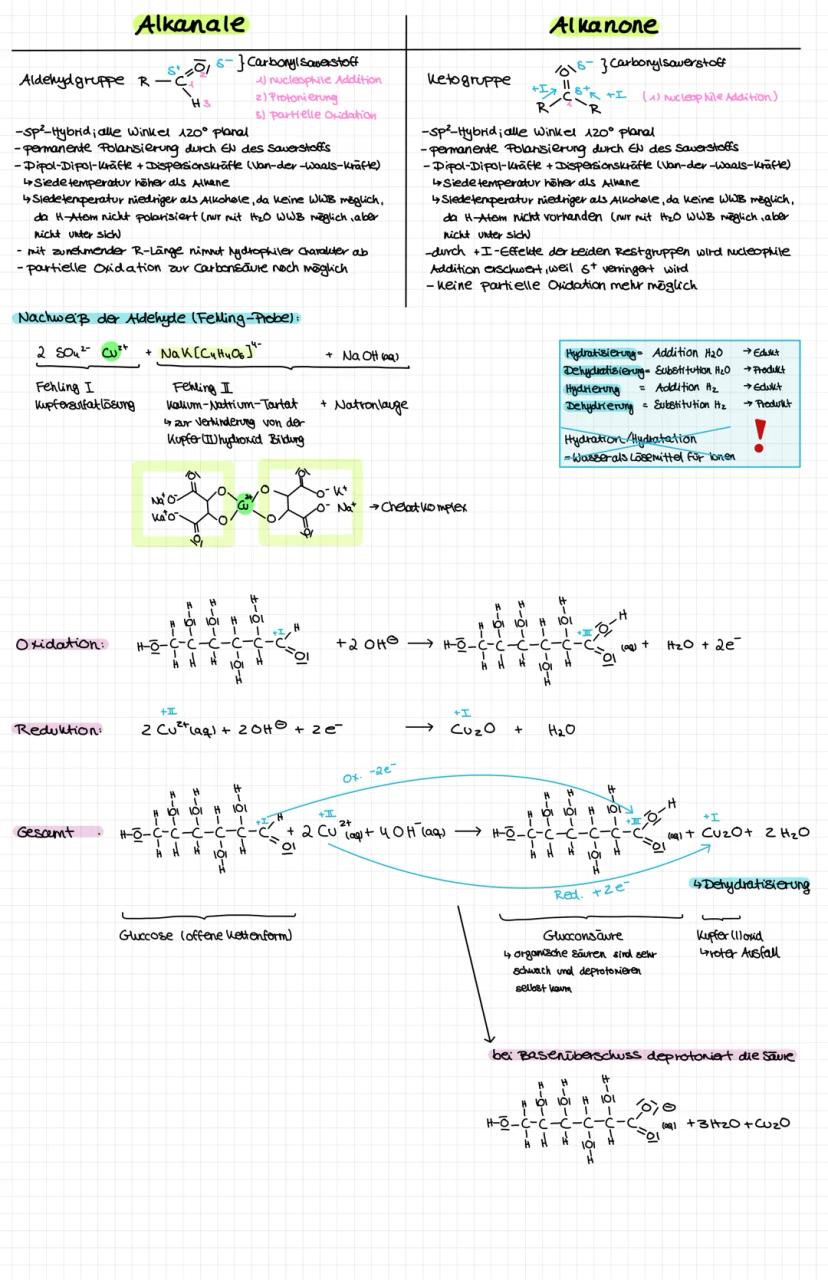
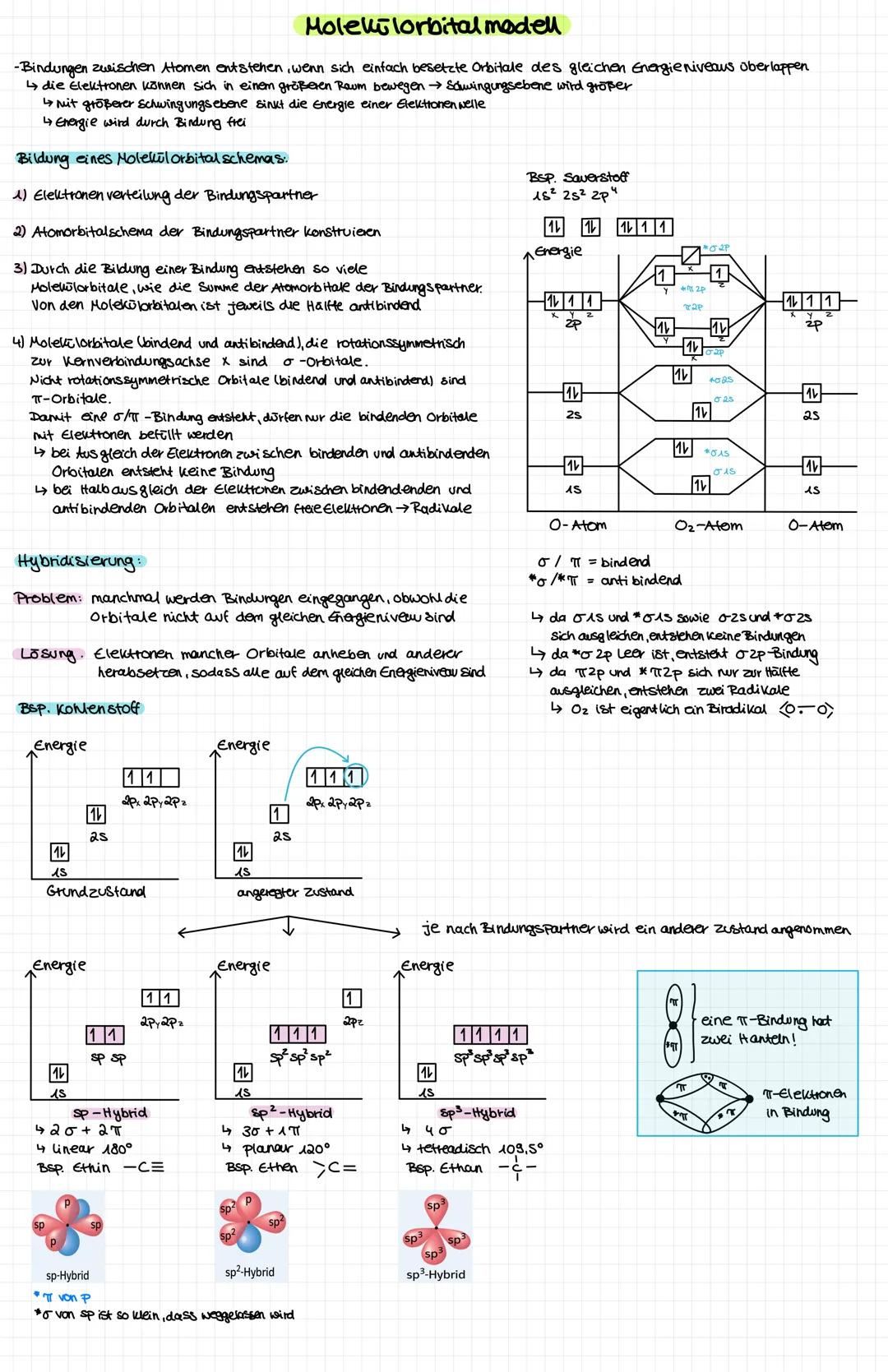
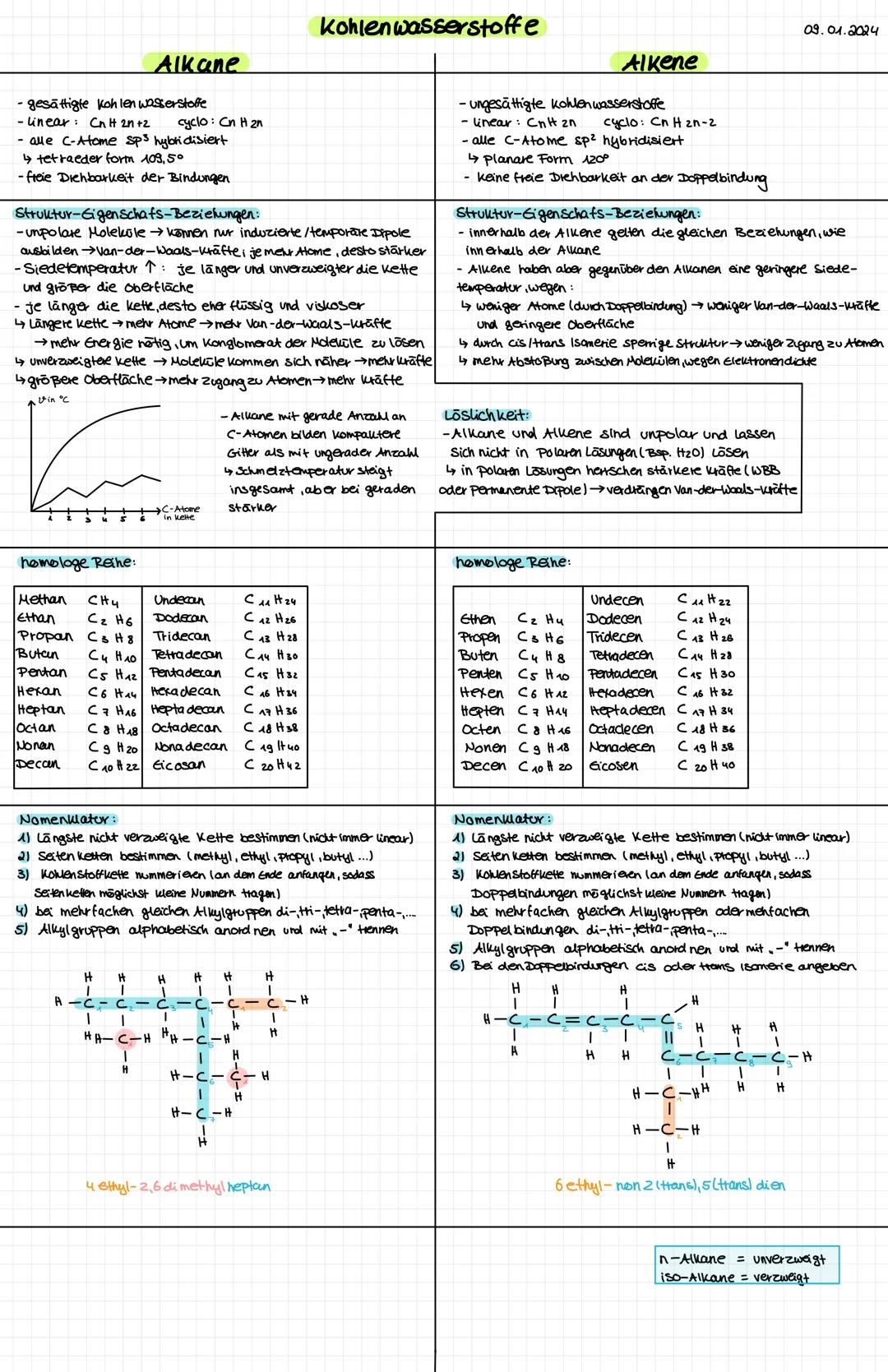
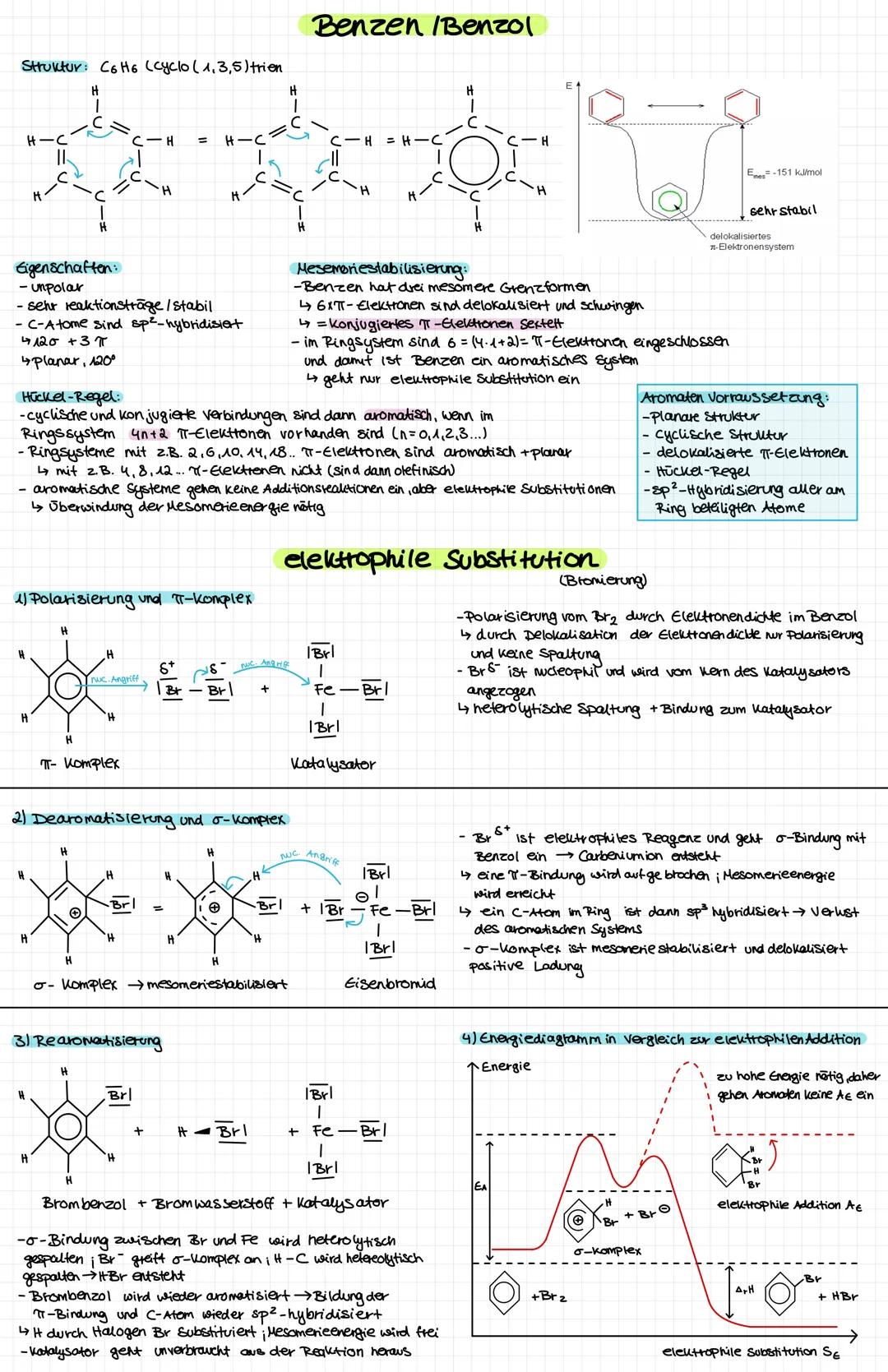
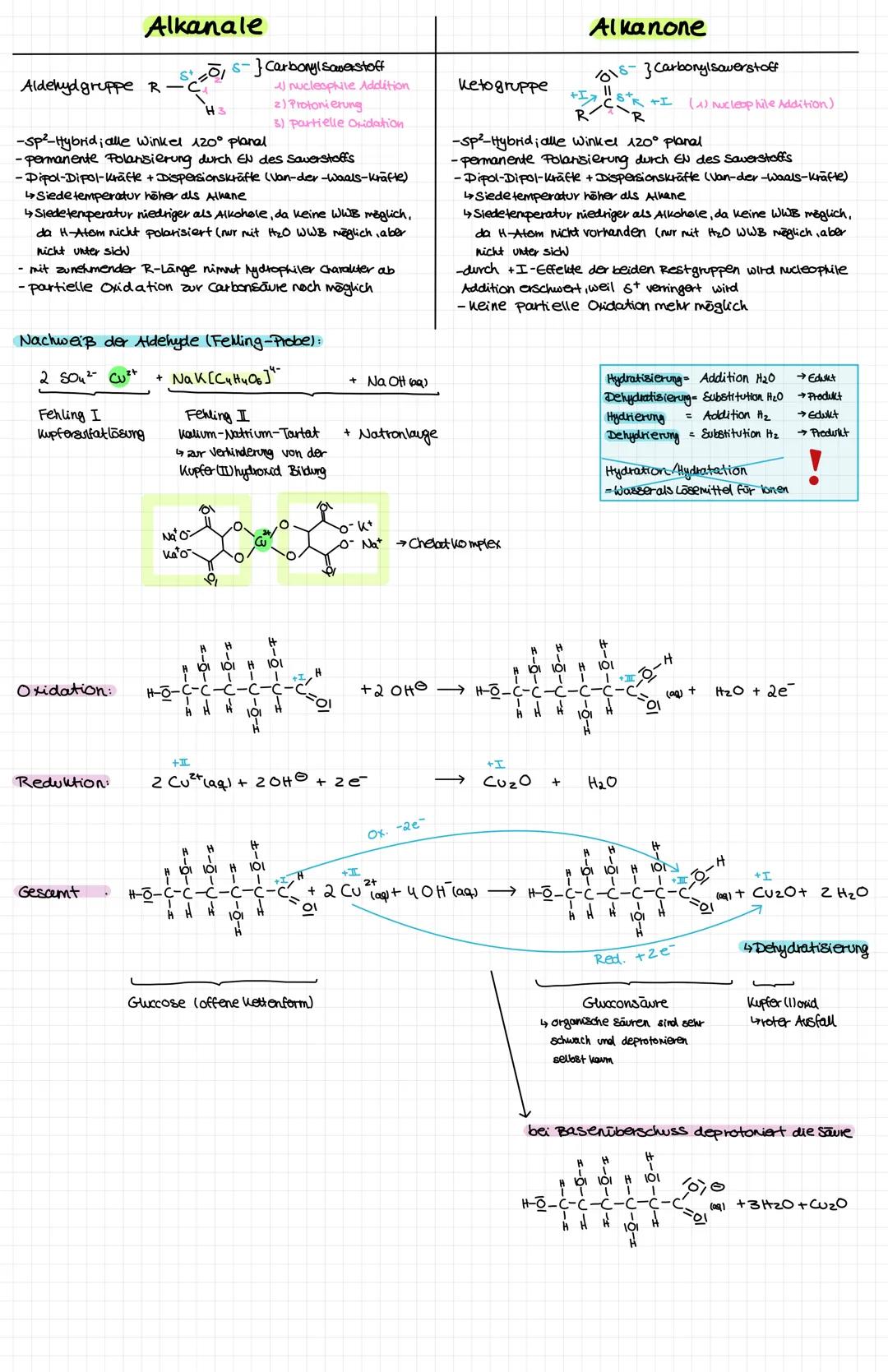
Orbitalmodell und Quantenzahlen
Stell dir vor, Elektronen sind wie Wellen in einem Kasten - genau das beschreibt das Orbitalmodell. Es zeigt dir, wo sich Elektronen mit welcher Wahrscheinlichkeit aufhalten.
Die Quantenzahlen sind wie die Adresse jedes Elektrons. Die Hauptquantenzahl n gibt das Energieniveau an n=1,2,3..., während die Nebenquantenzahl l die Form bestimmt: s-Orbitale sind kugelförmig l=0, p-Orbitale hantelförmig l=1.
Elektronenverteilung folgt klaren Regeln: Erst werden energieärmere Orbitale gefüllt, pro Orbital passen maximal zwei Elektronen mit unterschiedlichem Spin. Die Hund'sche Regel besagt, dass entartete Orbitale erst einzeln, dann paarweise besetzt werden.
Merktipp: Die Reihenfolge 1s, 2s, 2p, 3s, 3p, 4s, 3d... bestimmt die Elektronenkonfiguration aller Atome!