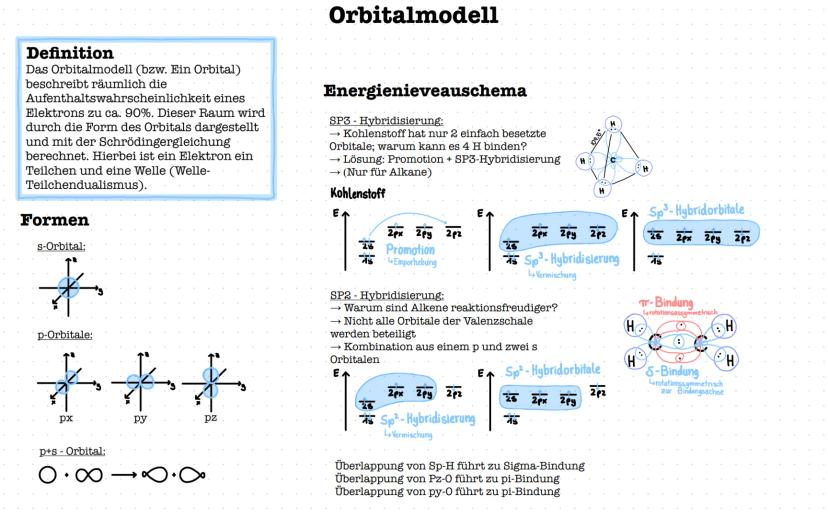
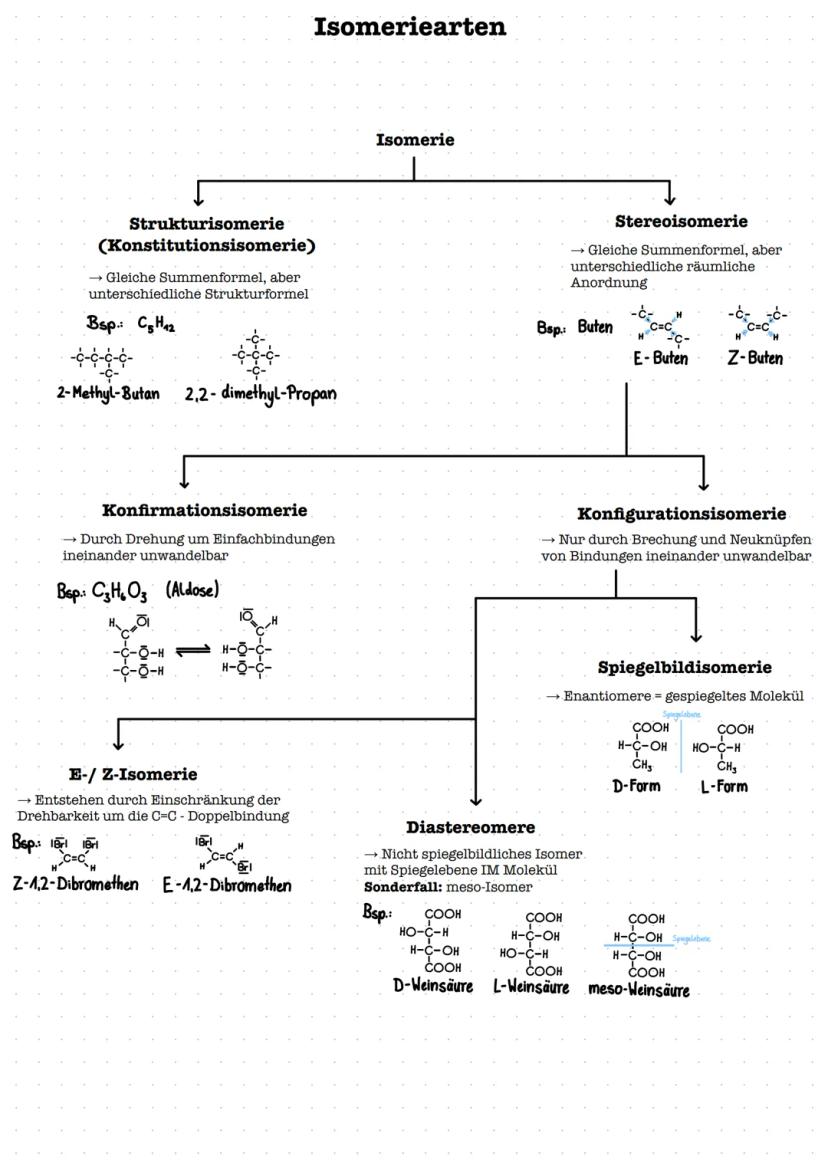
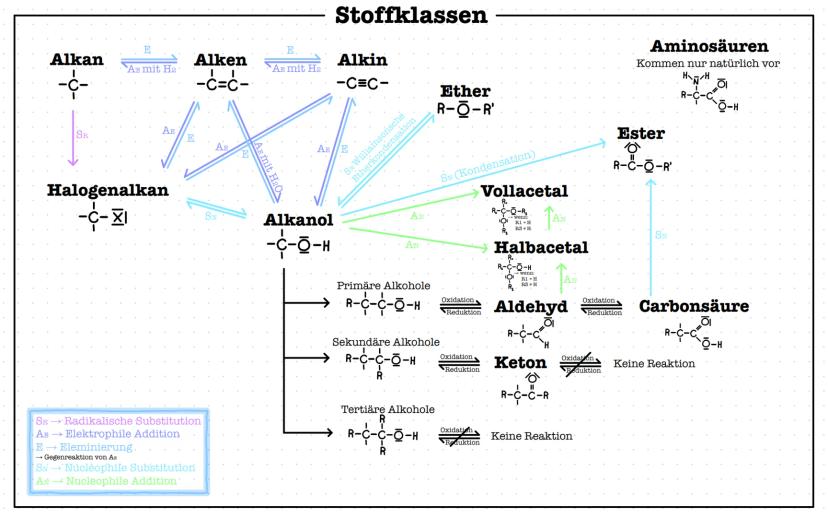
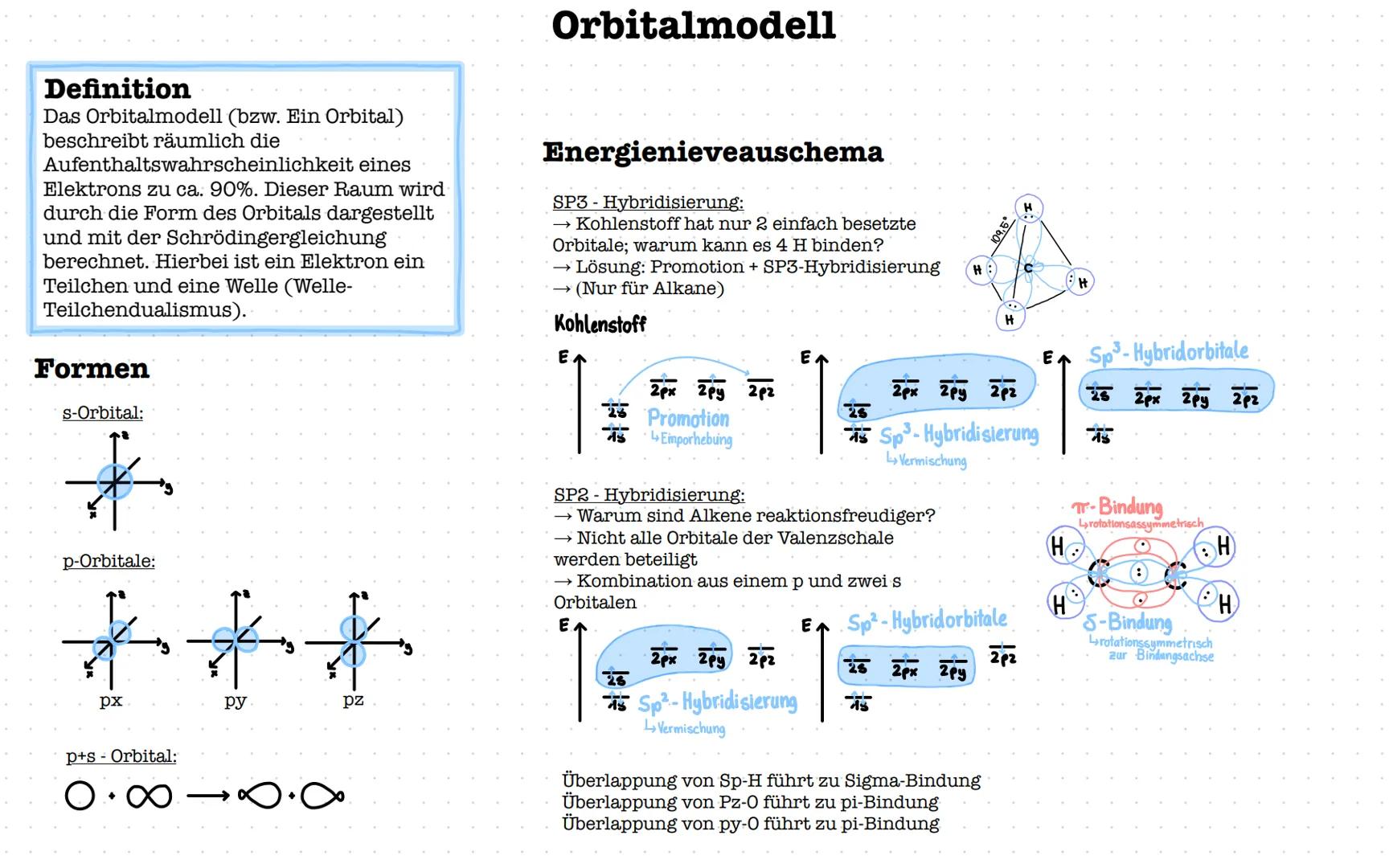
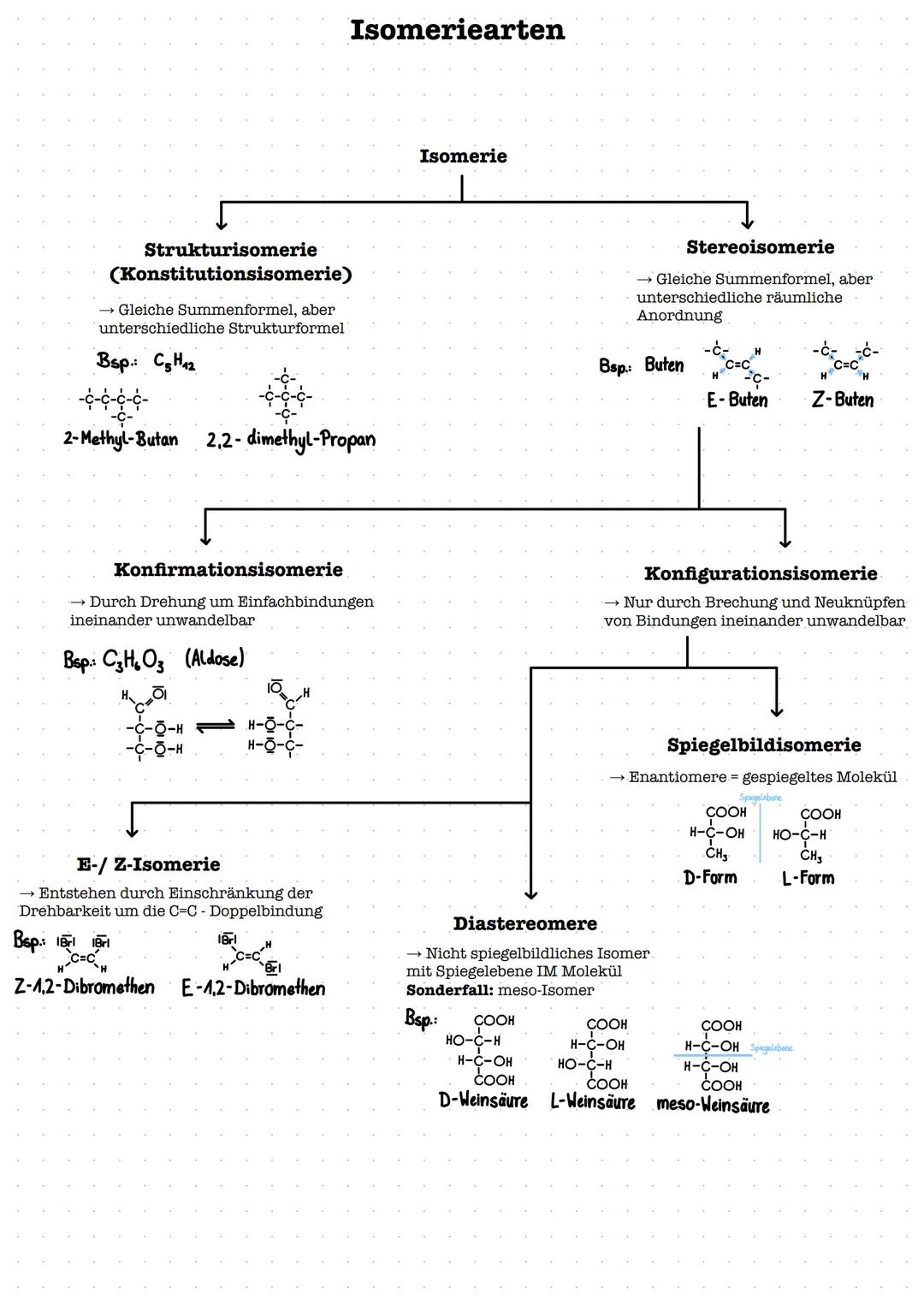
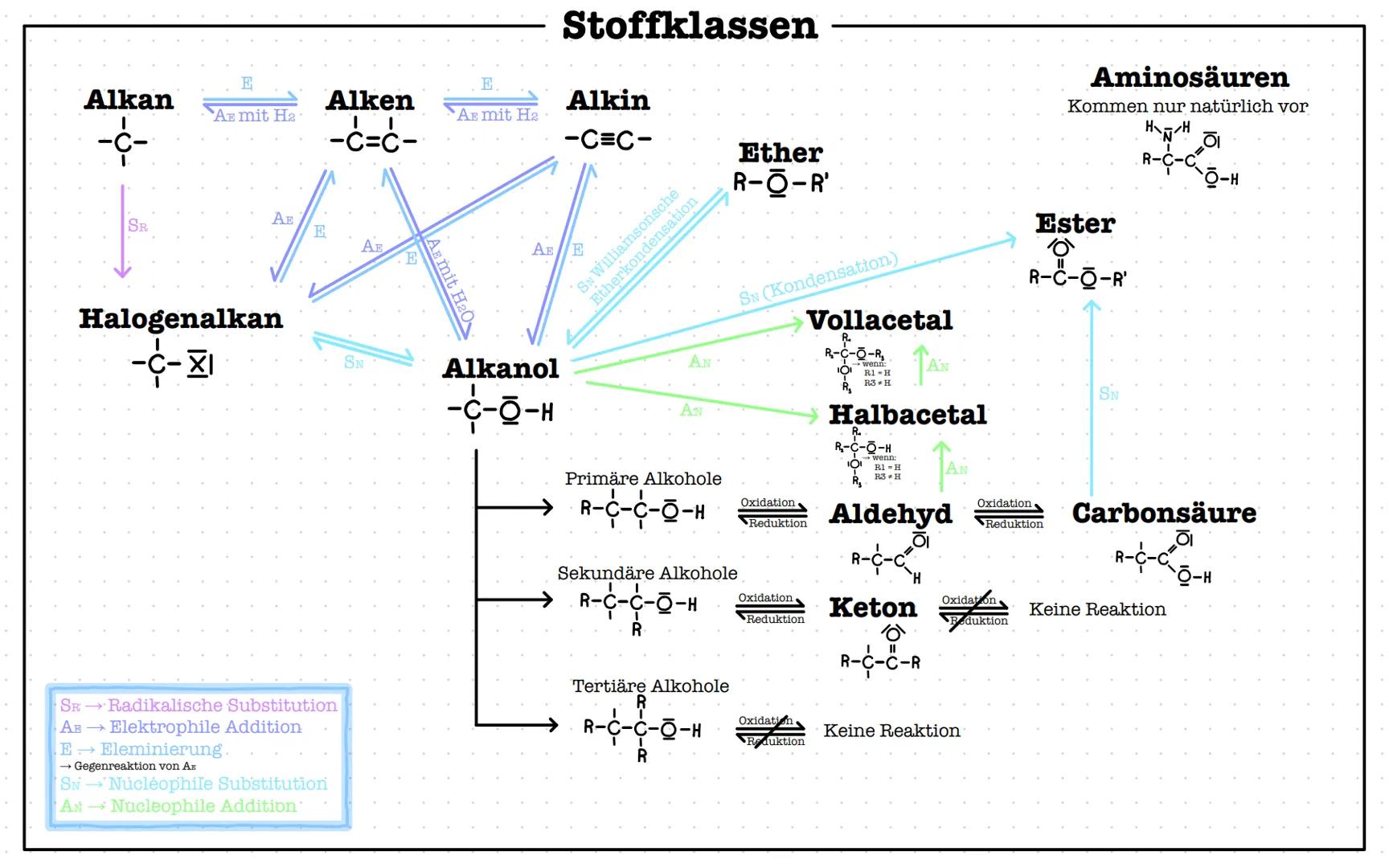
Chemische Bindungen und Grundlagen
Atombindungen sind der Schlüssel zum Verständnis der Chemie - sie entstehen durch gemeinsame Elektronenpaare zwischen Atomen. Diese kovalenten Bindungen halten Moleküle zusammen und sind eine der drei Hauptbindungsarten.
Bei Ionenbindungen ziehen sich gegensätzlich geladene Ionen elektrostatisch an. Die Elektronegativitätsdifferenz ΔEN verrät dir, welche Bindungsart vorliegt: 0-0,5 = unpolare kovalente Bindung, 0,5-1,7 = polare kovalente Bindung, >1,7 = Ionenbindung.
Zwischenmolekulare Kräfte bestimmen Eigenschaften wie Siedetemperatur. Van-der-Waals-Kräfte sind schwach, Dipol-Dipol-Wechselwirkungen entstehen bei polaren Molekülen, und Wasserstoffbrückenbindungen sind besonders stark (H mit N, O oder F).
Merktipp: Die Elektronegativitätsdifferenz ist dein Kompass für Bindungstypen!
Die wichtigsten Reaktionstypen sind: SR (radikalische Substitution), AE (elektrophile Addition), E (Eliminierung), SN (nucleophile Substitution), AN (nucleophile Addition), Kondensation und Hydrolyse.