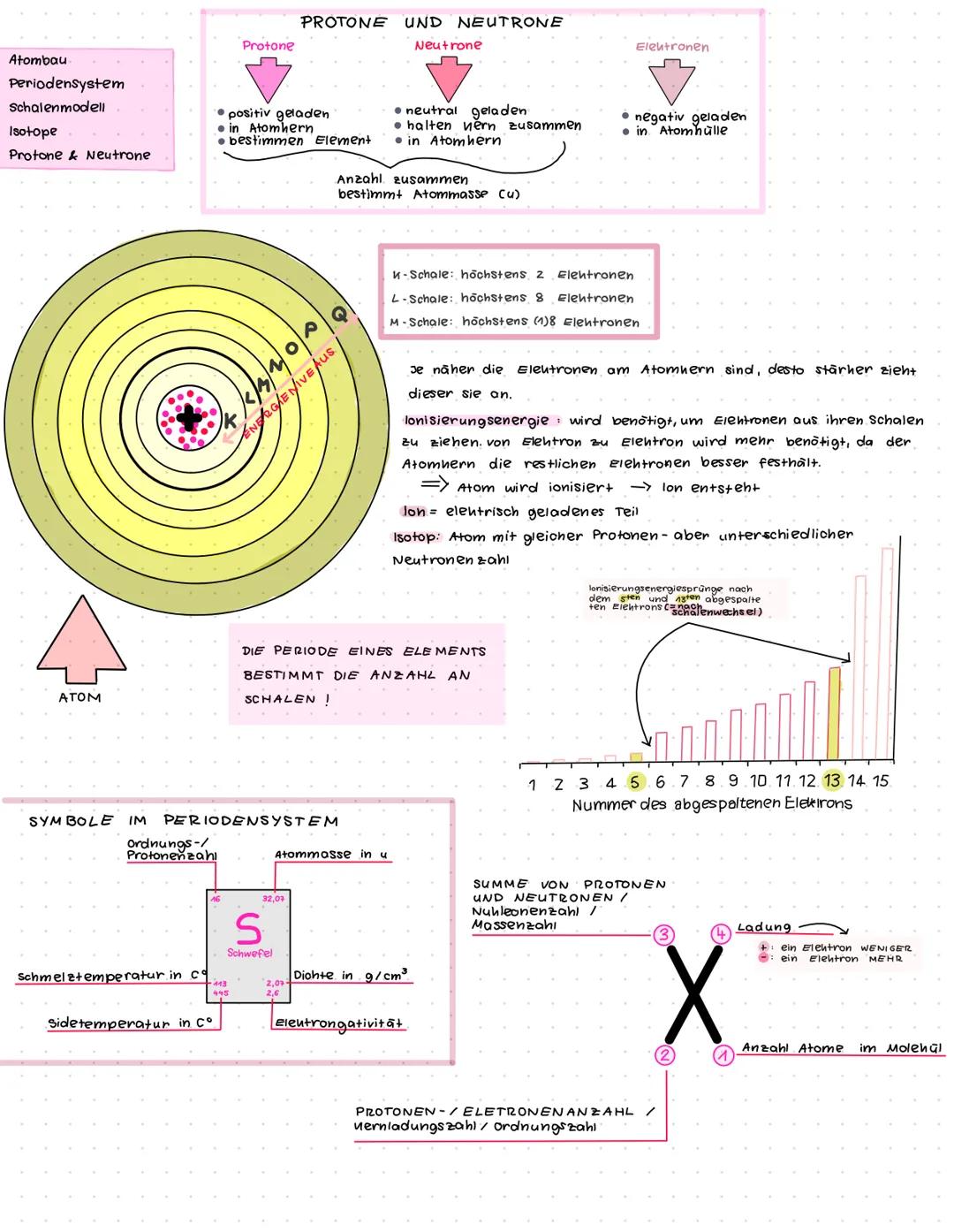
Atombau und das Periodensystem verstehen
Atome bestehen aus drei wichtigen Teilchen, die wie ein winziges Sonnensystem funktionieren. Im Zentrum sitzt der Atomkern mit Protonen (positiv geladen) und Neutronen (neutral geladen). Die Elektronen (negativ geladen) schwirren drumherum in der Atomhülle.
Die Anzahl der Protonen bestimmt, welches Element du vor dir hast - Wasserstoff hat 1 Proton, Sauerstoff hat 8. Isotope sind wie Geschwister: gleiche Protonenzahl, aber unterschiedlich viele Neutronen im Kern.
Das Periodensystem ist genial organisiert! Die Periode (Zeile) zeigt dir, wie viele Elektronenschalen ein Atom hat. Die K-Schale kann maximal 2 Elektronen aufnehmen, die L-Schale bis zu 8 Elektronen.
Merktipp: Je näher Elektronen am Kern sind, desto fester hält der Kern sie fest - deshalb braucht man mehr Ionisierungsenergie, um sie zu entfernen!
Wenn Atome Elektronen verlieren oder gewinnen, entstehen Ionen - elektrisch geladene Teilchen. Ein "+" bedeutet ein Elektron weniger, ein "-" bedeutet ein Elektron mehr.