Chemie-Grundwissen: Atome und Redoxreaktionen
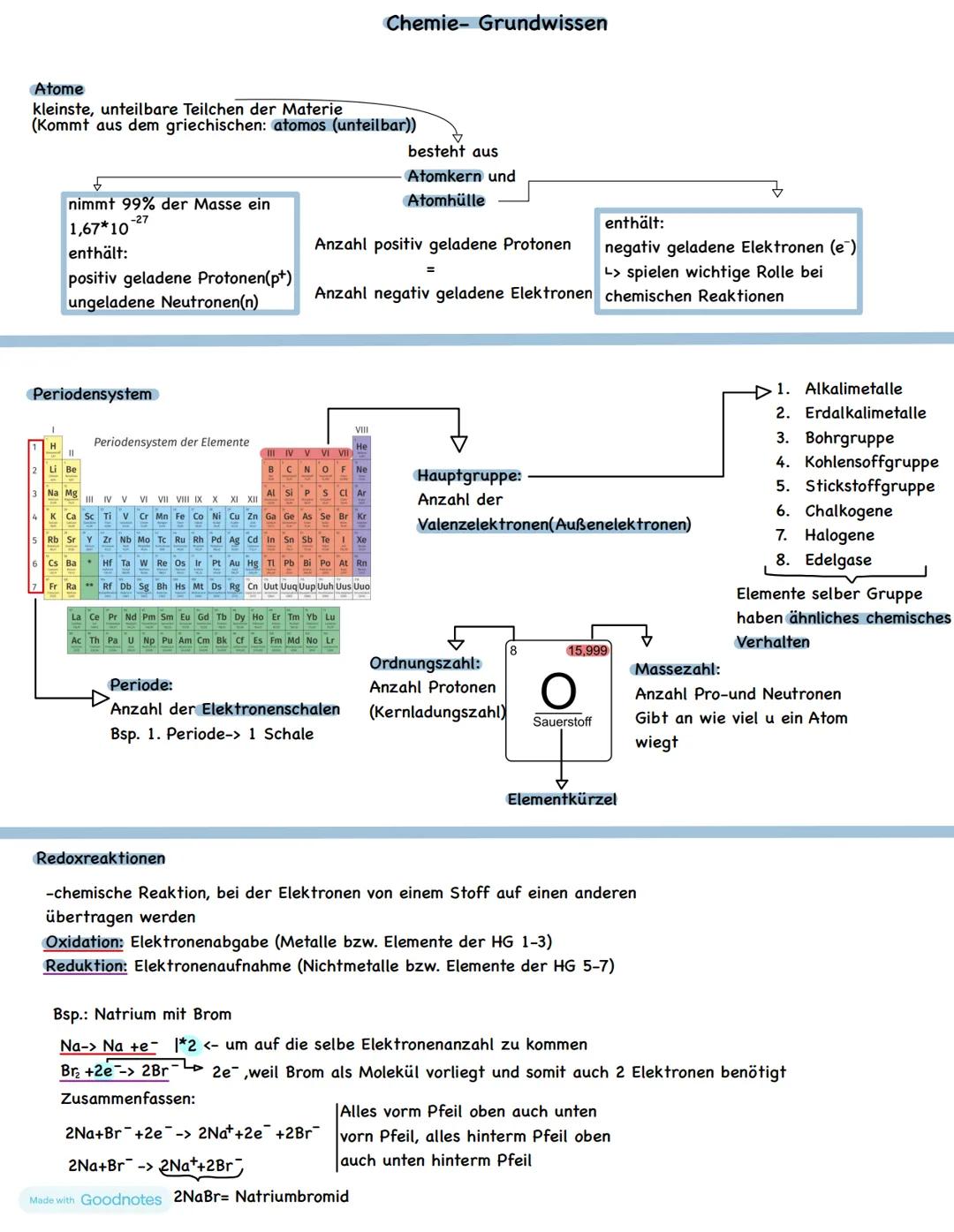
Atome sind die kleinsten Bausteine aller Materie um dich herum - von der Luft, die du atmest, bis zum Bildschirm, den du gerade anschaust. Der Name kommt aus dem Griechischen und bedeutet "unteilbar", auch wenn wir heute wissen, dass Atome aus noch kleineren Teilen bestehen.
Jedes Atom besteht aus einem Atomkern (mit positiv geladenen Protonen und neutralen Neutronen) und einer Atomhülle (mit negativ geladenen Elektronen). Das Coole dabei: Die Anzahl der Protonen entspricht immer der Anzahl der Elektronen, wodurch das Atom elektrisch neutral ist.
Das Periodensystem ist wie eine Landkarte der Elemente. Die Hauptgruppen (I bis VIII) zeigen dir, wie viele Außenelektronen ein Element hat - und das bestimmt sein chemisches Verhalten. Elemente derselben Gruppe verhalten sich ähnlich, deshalb explodieren sowohl Natrium als auch Kalium mit Wasser.
Redoxreaktionen sind Elektronentausch-Geschäfte: Ein Element gibt Elektronen ab (Oxidation), ein anderes nimmt sie auf (Reduktion). Beim Beispiel Natrium + Brom gibt Natrium ein Elektron ab Na→Na++e−, während Brom zwei Elektronen aufnimmt Br2+2e−→2Br−. Das Ergebnis: Natriumbromid (2NaBr).
Merktipp: Bei Redoxreaktionen gilt immer: Was abgegeben wird, muss auch aufgenommen werden - Elektronen gehen nie verloren!