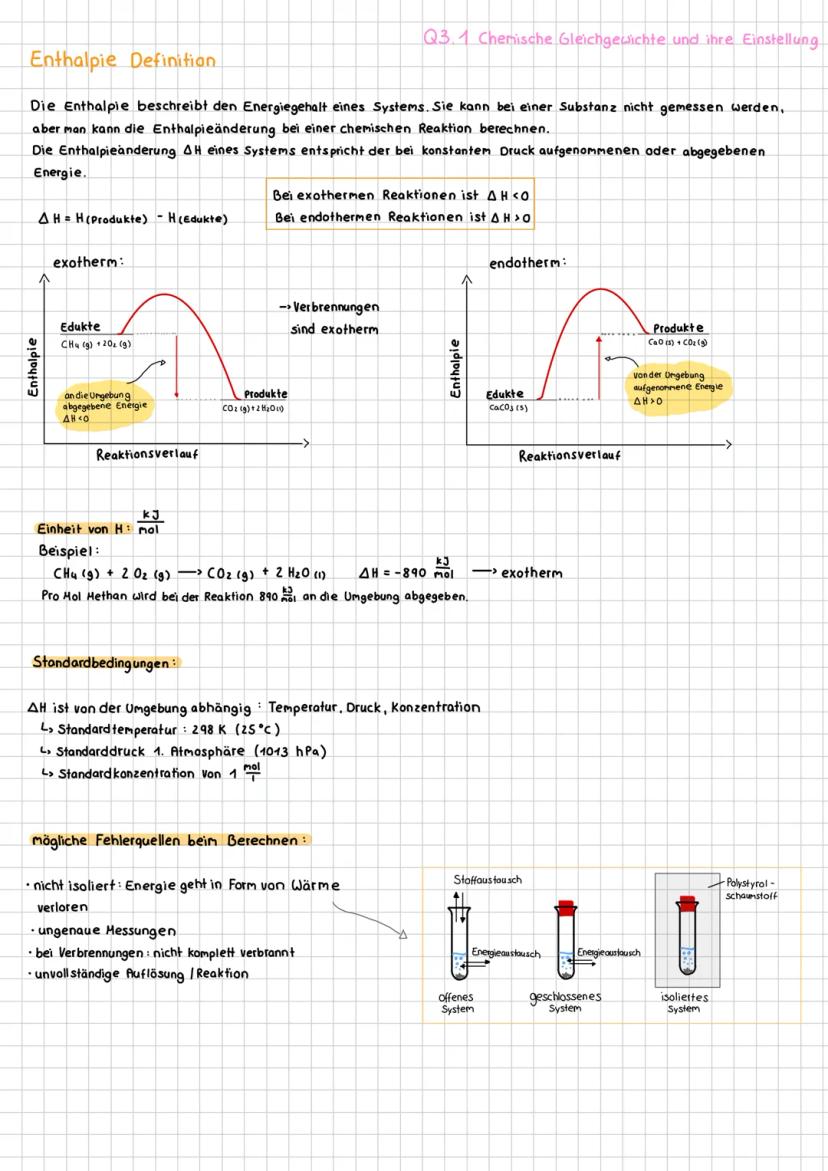
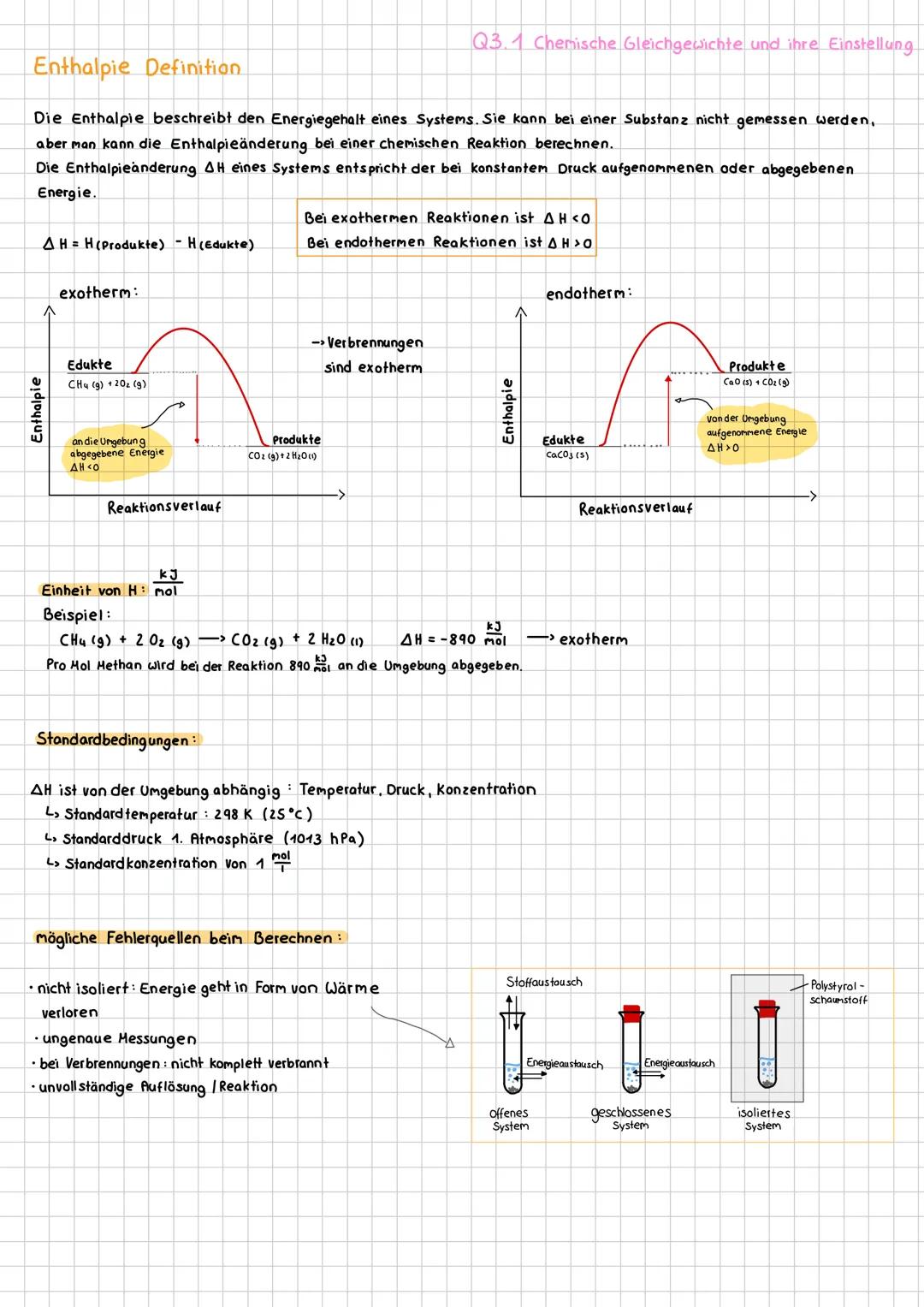
Berechnung von Enthalpien
Es gibt verschiedene Wege, Enthalpieänderungen zu berechnen – je nachdem, welche Daten du hast.
Bildungsenthalpie: Die Energie, die frei wird oder gebraucht wird, wenn 1 Mol einer Verbindung aus den Elementen entsteht. Du findest die Werte in Tabellen und rechnest: ΔH = Bildungsenthalpien(Produkte) - Bildungsenthalpien(Edukte).
Bindungsenthalpie: Hier schaust du, welche Bindungen gebrochen kostetEnergie,+ und welche gebildet werden gibtEnergie,−. Starke Bindungen haben hohe Bindungsenthalpien und sind kürzer.
Die Rechnung: ΔH = Energie für gebrochene Bindungen - Energie für gebildete Bindungen.
Faustregel: Bindungen brechen kostet immer Energie, Bindungen bilden gibt immer Energie frei!
Beispiel: Bei der Propan-Verbrennung musst du 5 O=O-Bindungen, 8 C-H-Bindungen und 2 C-C-Bindungen brechen, bildest aber 6 C=O-Bindungen und 8 O-H-Bindungen. Ergebnis: -2054 kJ/mol.