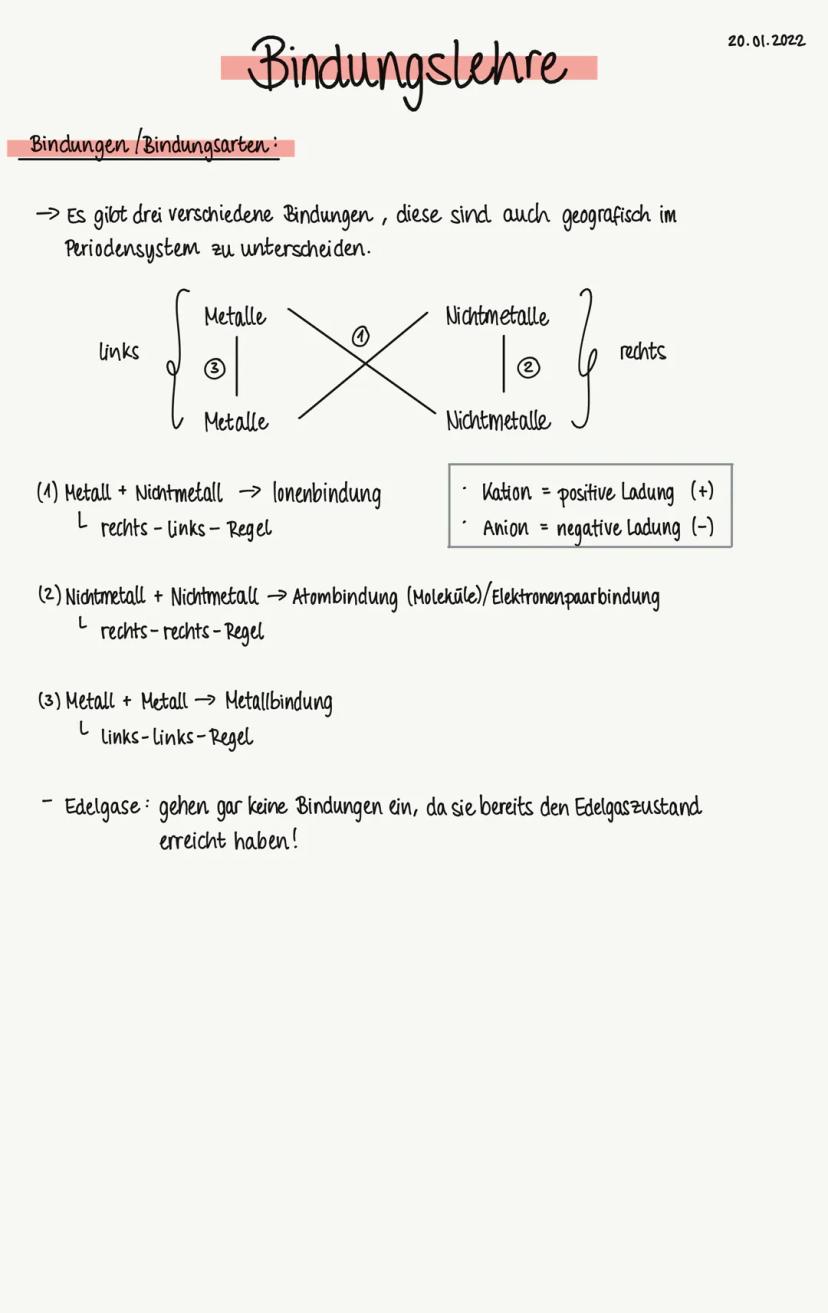
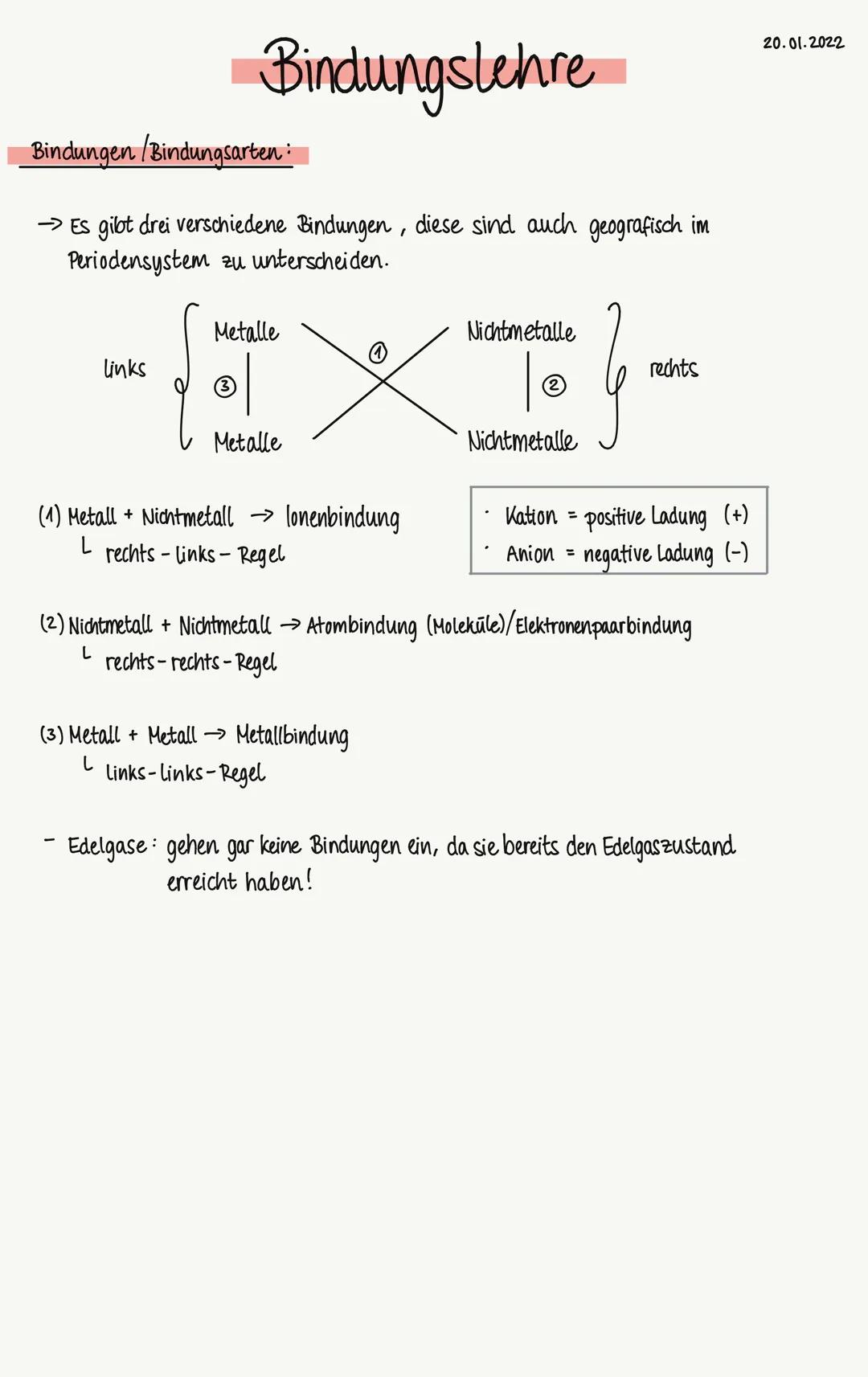
Zwischenmolekulare Kräfte - Warum Stoffe unterschiedlich sind
Zwischenmolekulare Kräfte erklären, warum Wasser bei 100°C siedet, aber Methan schon bei -162°C. Diese Anziehungskräfte zwischen Molekülen bestimmen Schmelz- und Siedepunkte sowie die Löslichkeit.
Van-der-Waals-Kräfte sind die schwächsten Kräfte. Sie entstehen durch zufällige Elektronenbewegungen, die temporäre Dipole erzeugen. Diese beeinflussen benachbarte Moleküle und erzeugen weitere temporäre Dipole. Je mehr Elektronen ein Molekül hat, desto stärker werden diese Kräfte.
Dipol-Dipol-Wechselwirkungen sind stärker und wirken nur zwischen polaren Molekülen. Der negative Pol eines Moleküls zieht den positiven Pol eines anderen an.
Wasserstoffbrücken sind die stärksten zwischenmolekularen Kräfte. Du brauchst ein H-Atom an N, O oder F (aktive Stelle) und ein freies Elektronenpaar an N, O oder F (passive Stelle).
🔬 Laborwissen: Wasserstoffbrücken erklären, warum Wasser so besondere Eigenschaften hat!