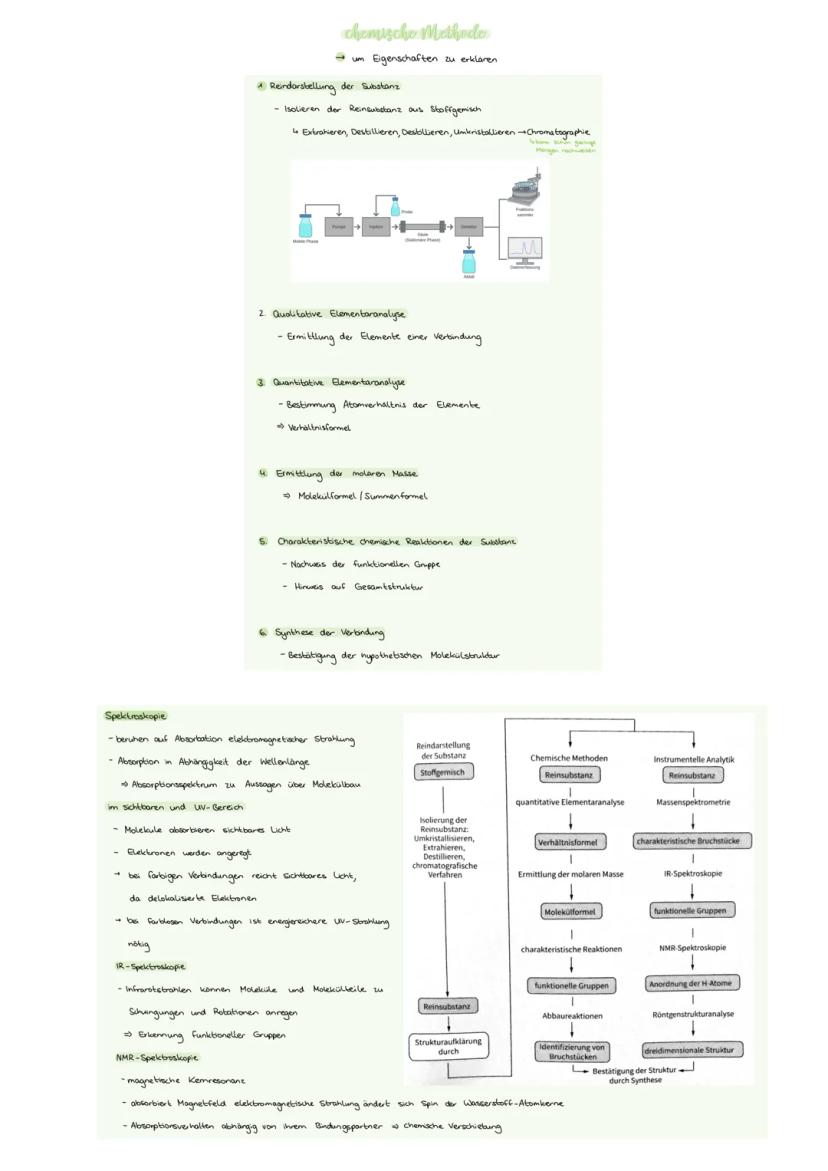
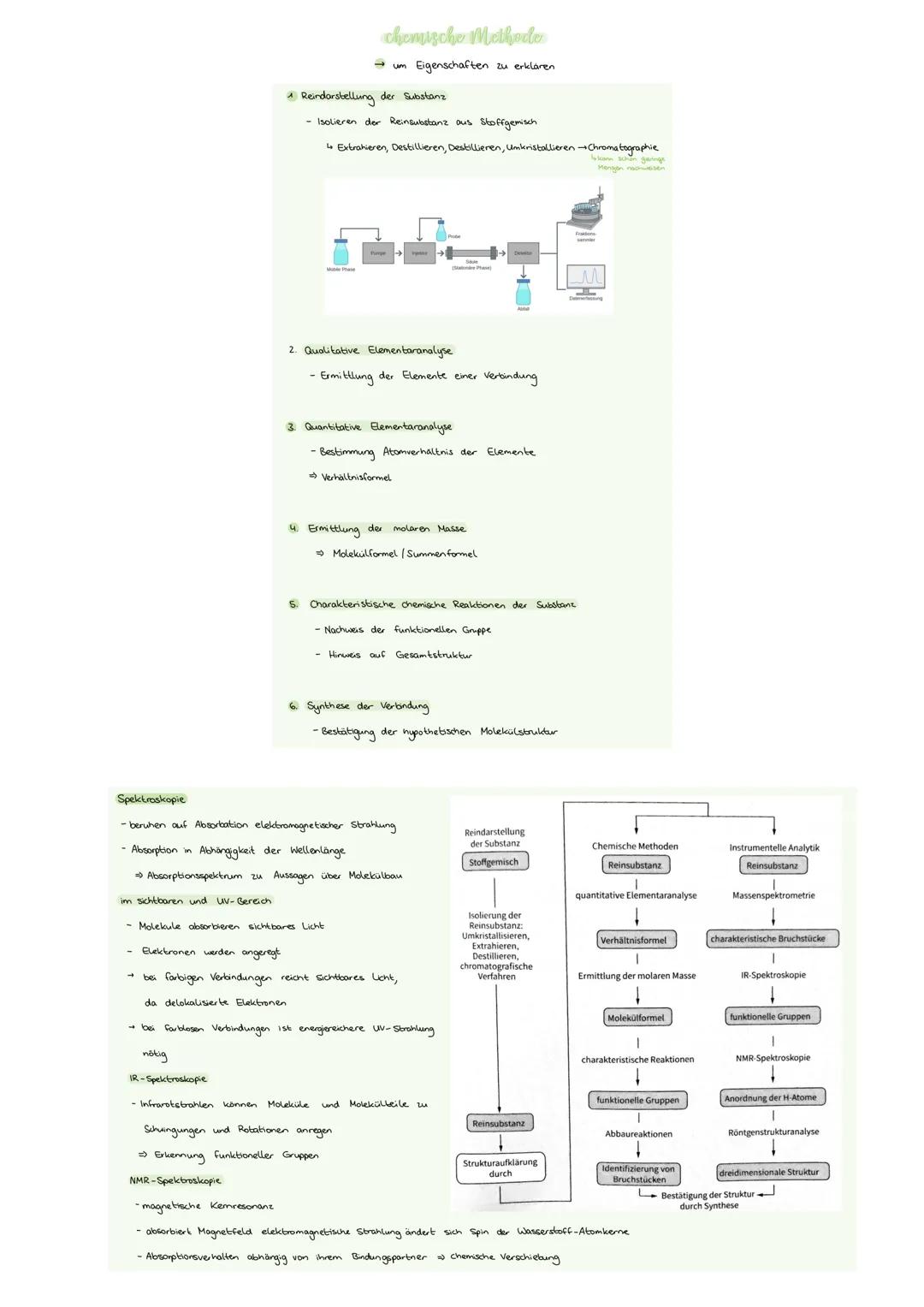
Atombau und Ionen
Atome bestehen aus einem Kern mit Protonen und Neutronen, umgeben von Elektronenschalen. Die K-Schale fasst maximal 2 Elektronen, jede weitere Schale maximal 8. Die Valenzelektronen in der äußersten Schale bestimmen das chemische Verhalten.
Isotope haben gleiche Protonenzahl, aber unterschiedliche Neutronenzahl. Die Gruppennummer im Periodensystem zeigt die Anzahl der Valenzelektronen, die Periodenzahl die Schalenanzahl. Beim Energiestufenmodell benötigst du Ionisierungsenergie, um Elektronen zu entfernen - je näher am Kern, desto mehr Energie.
Ionen sind geladene Teilchen: Metalle bilden positive Kationen, Nichtmetalle negative Anionen. Salze haben deshalb typische Eigenschaften: kristalline Struktur, hohe Schmelztemperaturen, Härte und Sprödigkeit. Sie leiten nur gelöst oder geschmolzen Strom, weil dann die Ionen beweglich sind.
Praxistipp: Die Elektrolyse ist die Umkehrung der Salzbildung - durch elektrische Spannung wandern Kationen zur Kathode und Anionen zur Anode.