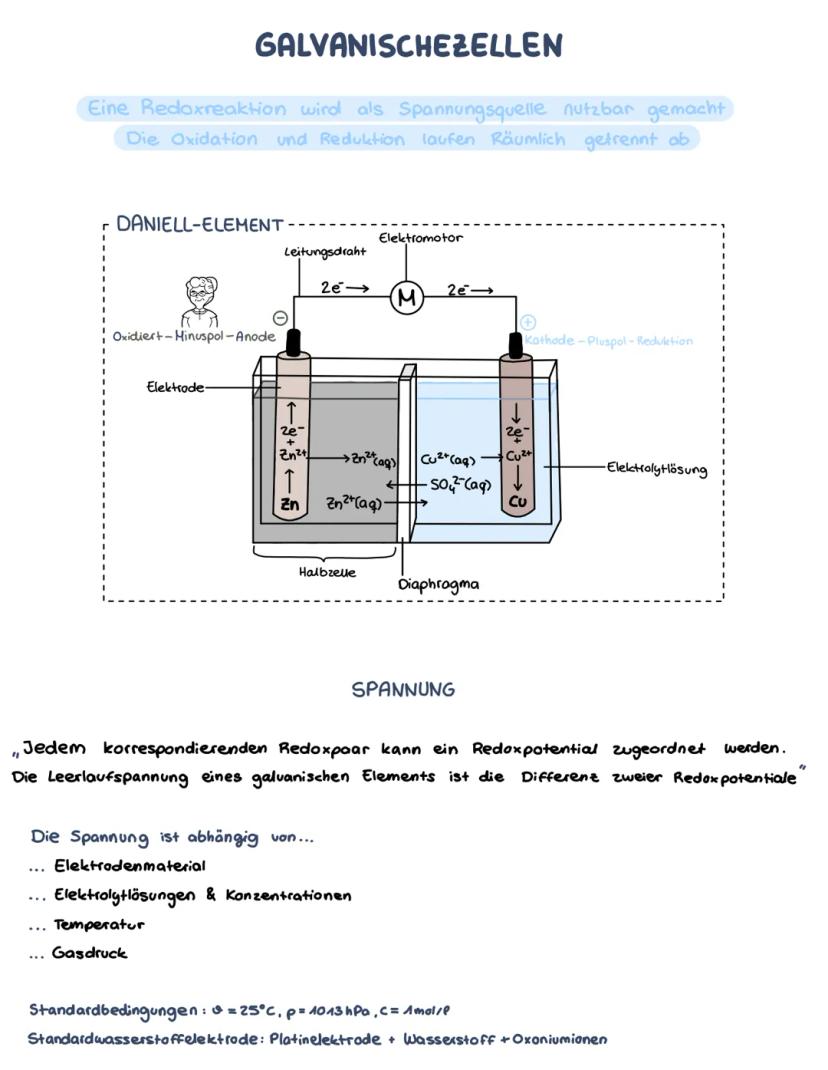
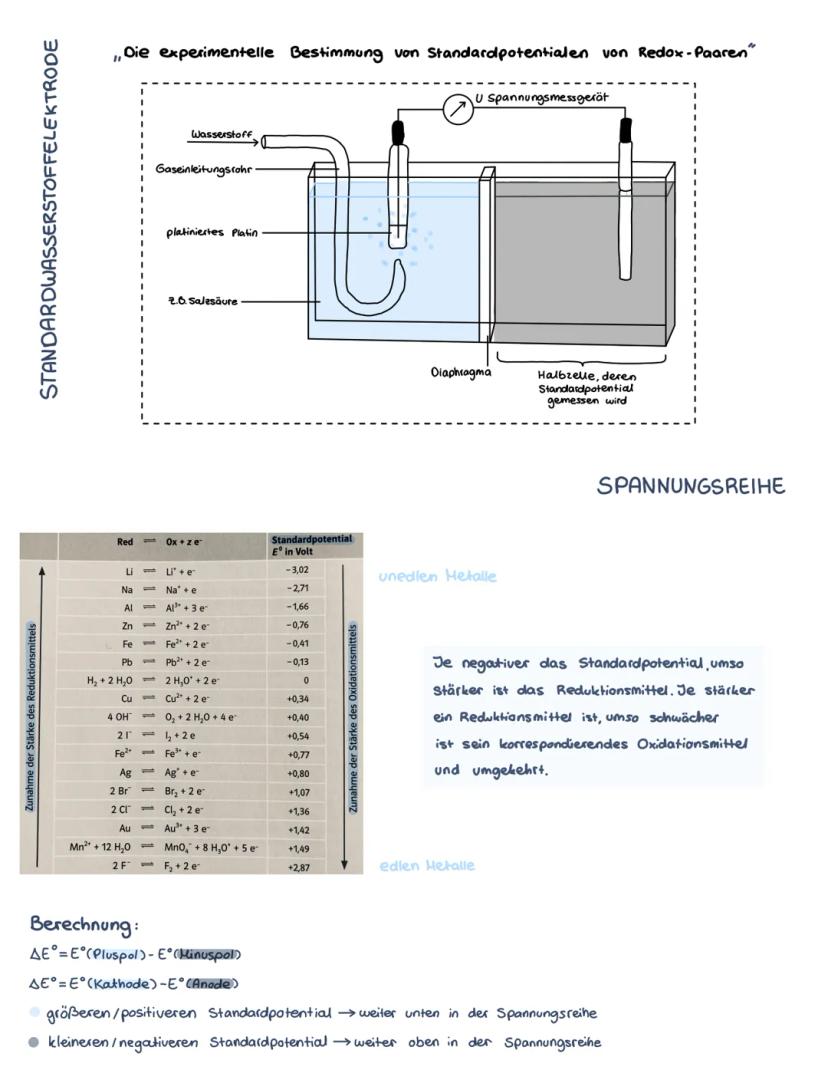
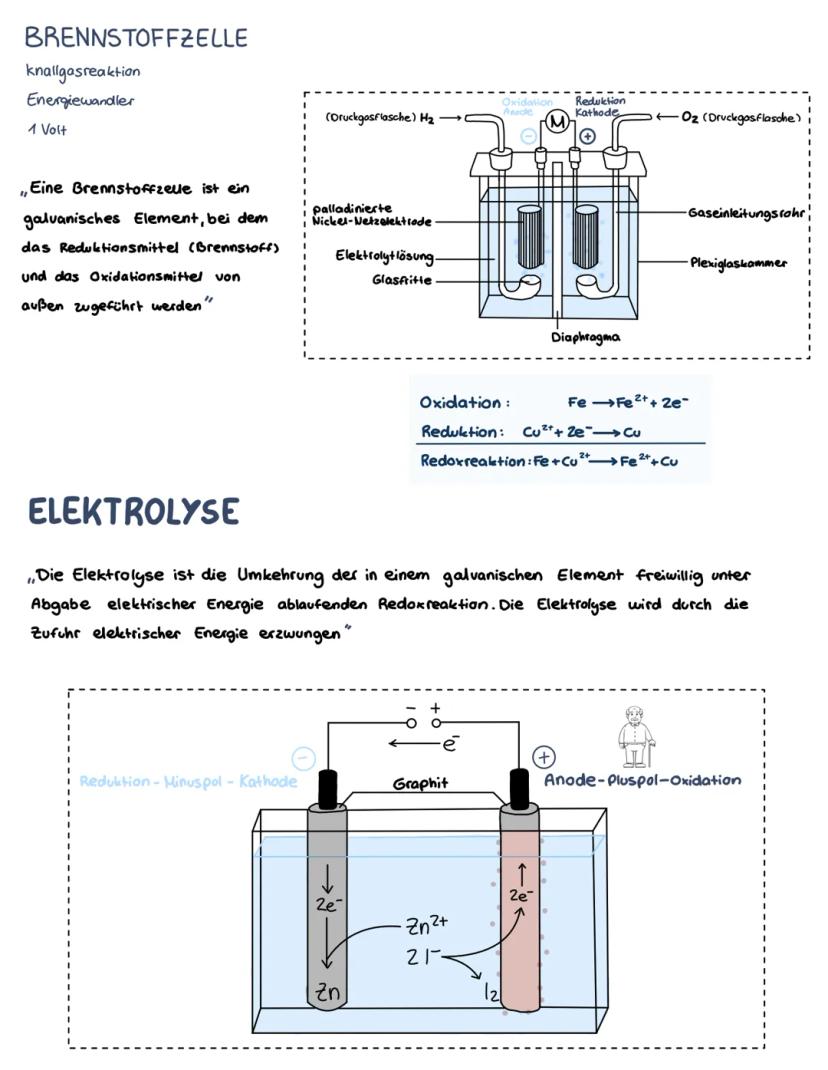
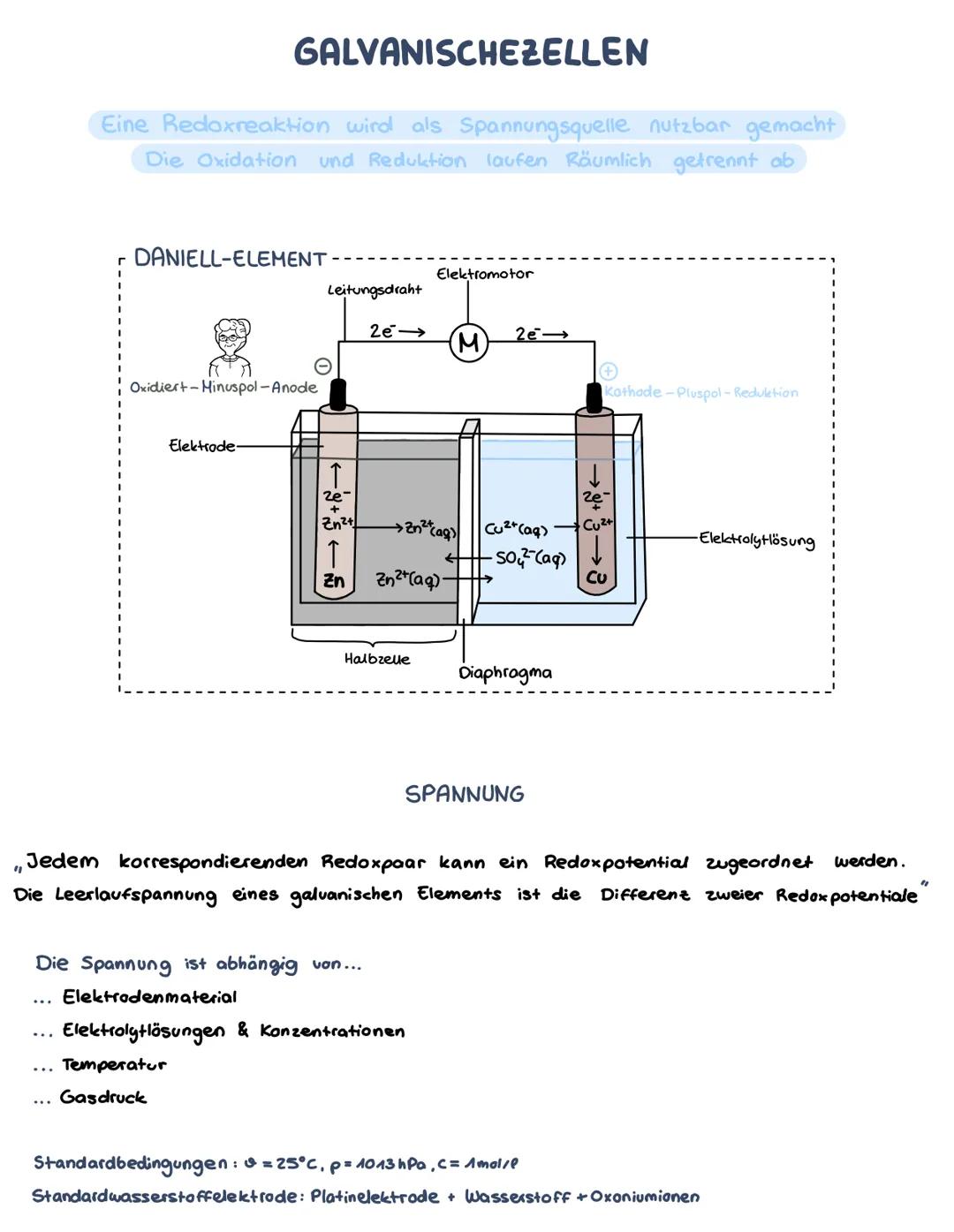
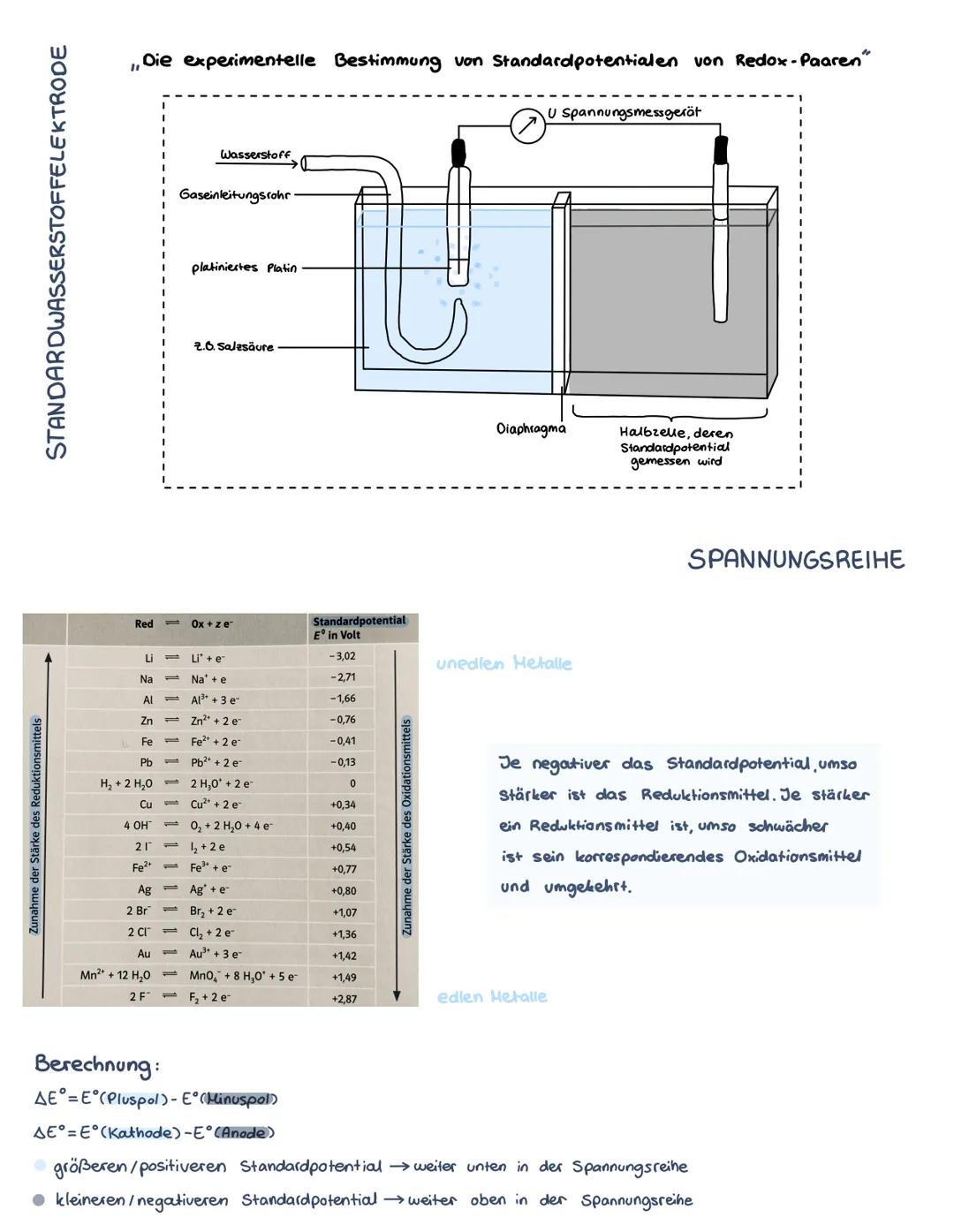
Die Spannungsreihe
Die Spannungsreihe ordnet alle Redoxpaare nach ihren Standardpotentialen. Oben stehen unedle Metalle wie Lithium −3,02V, unten edle Metalle wie Gold +1,42V. Die Wasserstoffelektrode liegt bei 0 V als Bezugspunkt.
Je negativer das Standardpotential, desto stärker ist das Reduktionsmittel. Umgekehrt: Je positiver das Potential, desto stärker das Oxidationsmittel. Lithium ist also ein sehr starkes Reduktionsmittel, Fluor ein sehr starkes Oxidationsmittel.
Mit der Formel ΔE° = E°(Kathode) - E°(Anode) berechnest du die Spannung einer galvanischen Zelle. Das Element mit dem positiveren Potential wird zur Kathode, das mit dem negativeren zur Anode.
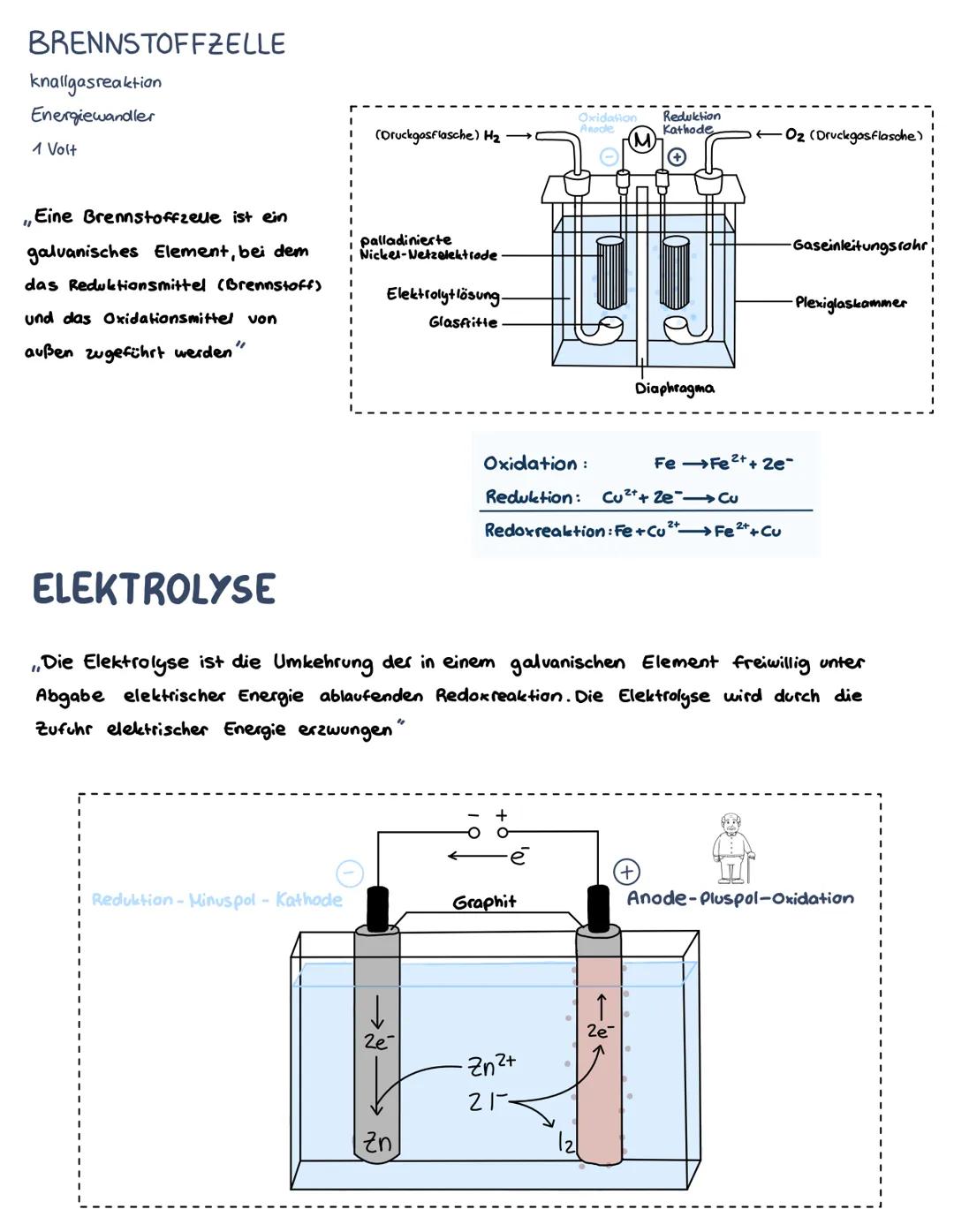
Praxistipp: Nur Redoxreaktionen mit positivem ΔE° laufen freiwillig ab!