Exotherme und Endotherme Reaktionen
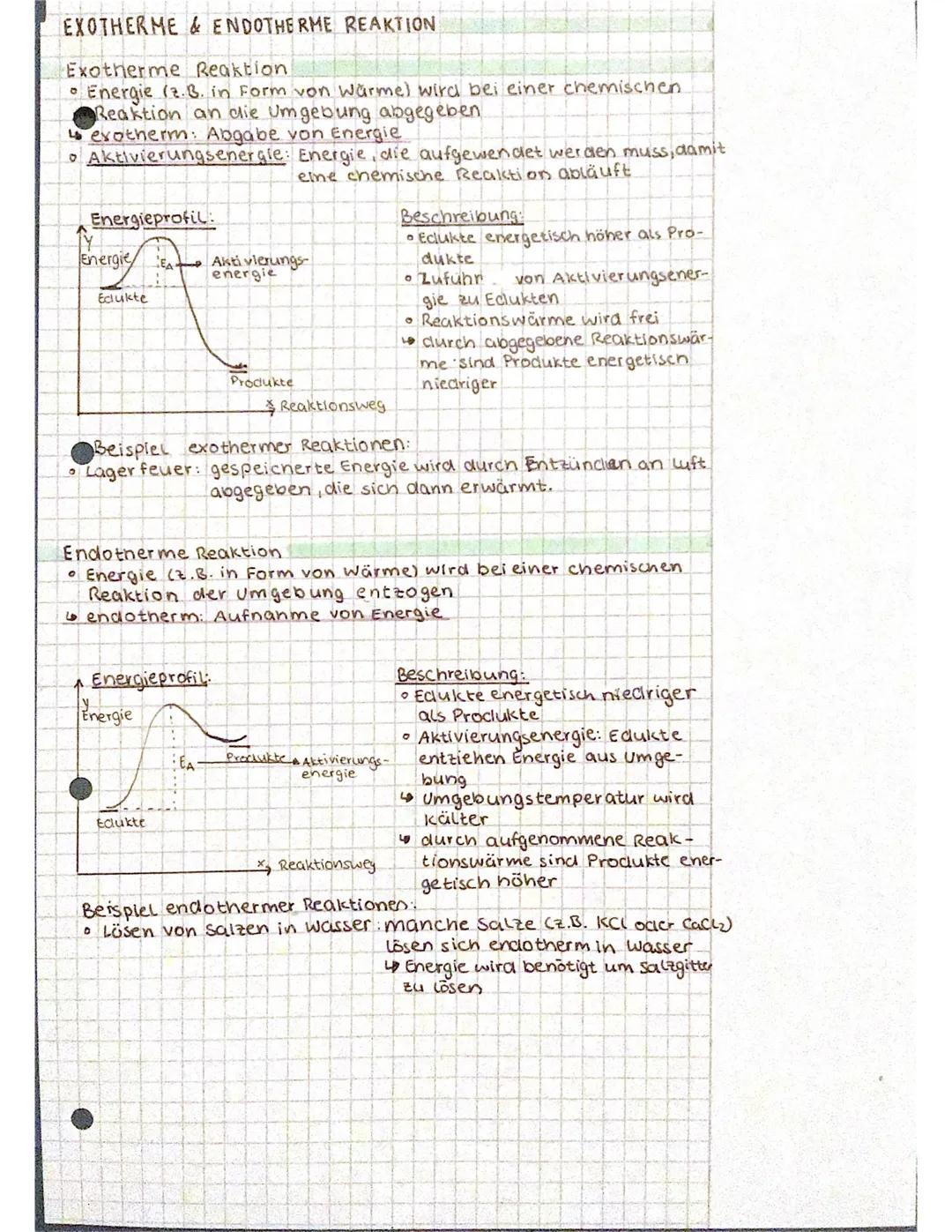
Exotherme Reaktionen sind wie ein warmes Lagerfeuer - sie geben Energie in Form von Wärme an ihre Umgebung ab. Du merkst das daran, dass es um die Reaktion herum wärmer wird. Die Aktivierungsenergie ist dabei wie ein Initialzündung - du musst erst mal Energie reinstecken, damit die Reaktion überhaupt startet.
Im Energieprofil siehst du, dass die Ausgangsstoffe (Edukte) energetisch höher liegen als die Endprodukte. Das bedeutet: Am Ende ist Energie übrig, die als Wärme freigesetzt wird.
Endotherme Reaktionen funktionieren genau andersherum - sie klauen Energie aus ihrer Umgebung. Wenn du bestimmte Salze wie KCl in Wasser löst, wird das Wasser kälter, weil die Reaktion Energie braucht, um das Salzgitter aufzubrechen.
💡 Merktrick: Exo = Exit (Energie geht raus), Endo = Enter (Energie geht rein)
Bei endothermen Reaktionen liegen die Produkte energetisch höher als die Edukte - die Reaktion muss also Energie "sammeln", um die Produkte zu bilden.