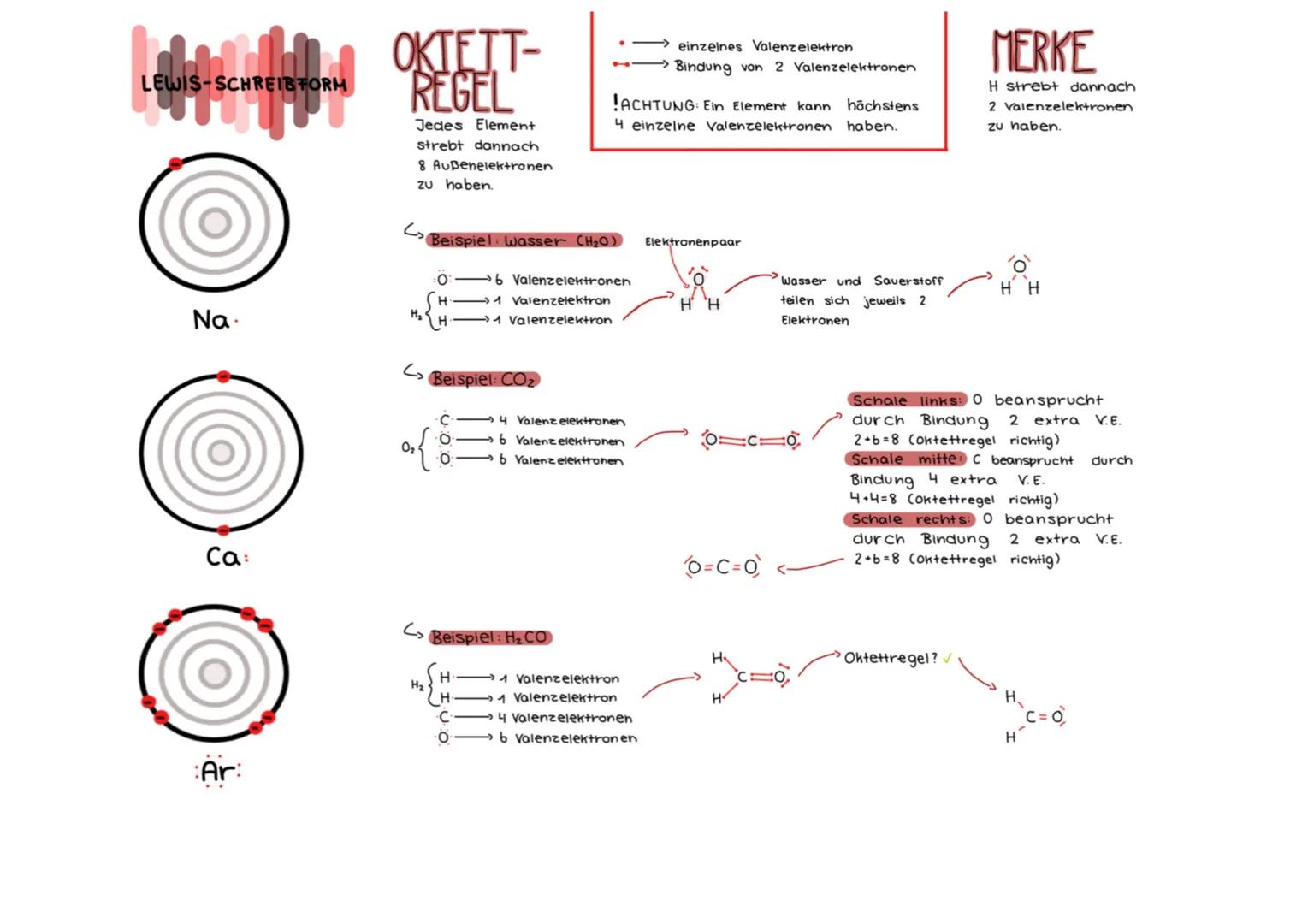
Lewis-Schreibform und Oktettregel
Die Oktettregel besagt, dass Atome danach streben, acht Außenelektronen (Valenzelektronen) zu haben. Dies erklärt, warum und wie Atome Bindungen eingehen. Wasserstoff ist eine Ausnahme – er strebt nach nur zwei Valenzelektronen.
Bei der Lewis-Schreibweise werden Valenzelektronen als Punkte um das Elementsymbol dargestellt. Elektronenpaare, die Bindungen bilden, werden als Striche zwischen den Atomen gezeichnet. Ein Element kann höchstens vier einzelne Valenzelektronen haben.
Am Beispiel Wasser (H₂O) sehen wir diese Prinzipien: Sauerstoff hat 6 Valenzelektronen, jeder Wasserstoff hat 1. Durch Bindungen teilen sie Elektronen, sodass Sauerstoff auf 8 und jeder Wasserstoff auf 2 Elektronen kommt.
Auch CO₂ folgt der Oktettregel: Kohlenstoff (4 Valenzelektronen) bildet mit jedem Sauerstoff (je 6 Valenzelektronen) eine Doppelbindung. So erreichen alle Atome 8 Valenzelektronen. Bei Formaldehyd (H₂CO) bilden sich Einfachbindungen zwischen C und H, aber eine Doppelbindung zwischen C und O.
Hinweis: Wenn du Moleküle mit Lewis-Formeln zeichnest, zähle immer die Valenzelektronen aller beteiligten Atome zusammen und prüfe, ob die Oktettregel oderbeiHdieDuett−Regel erfüllt ist!