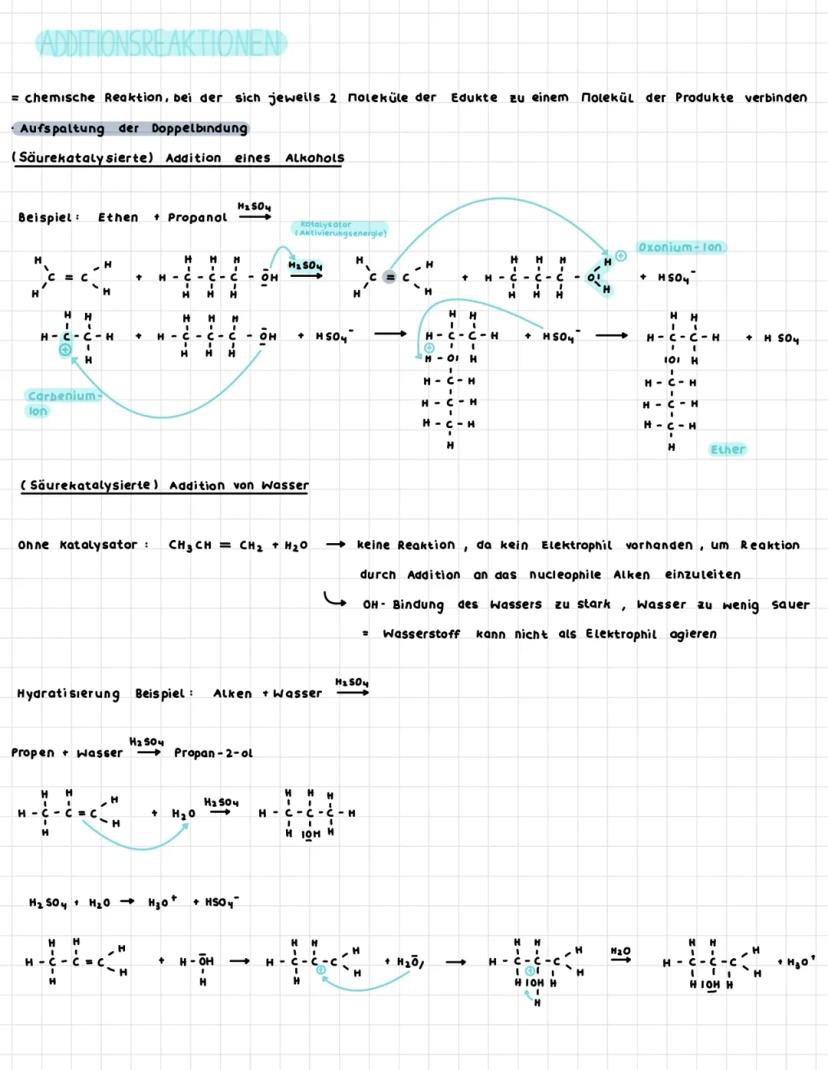
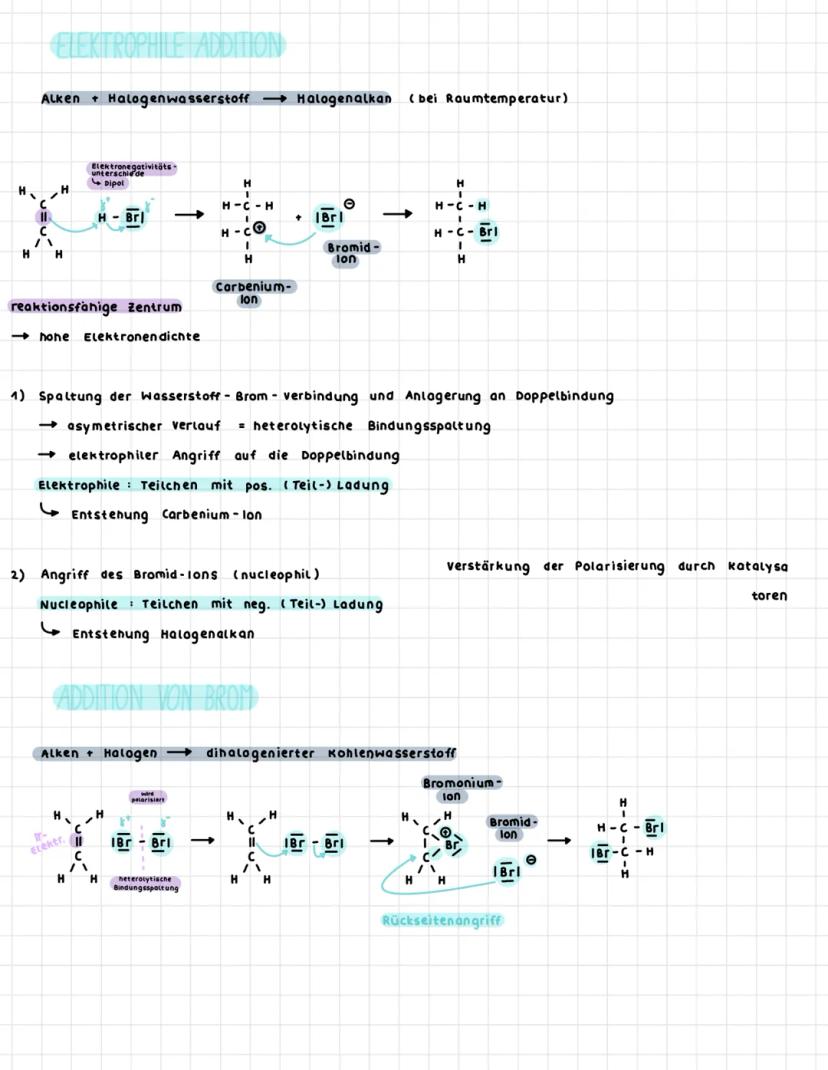
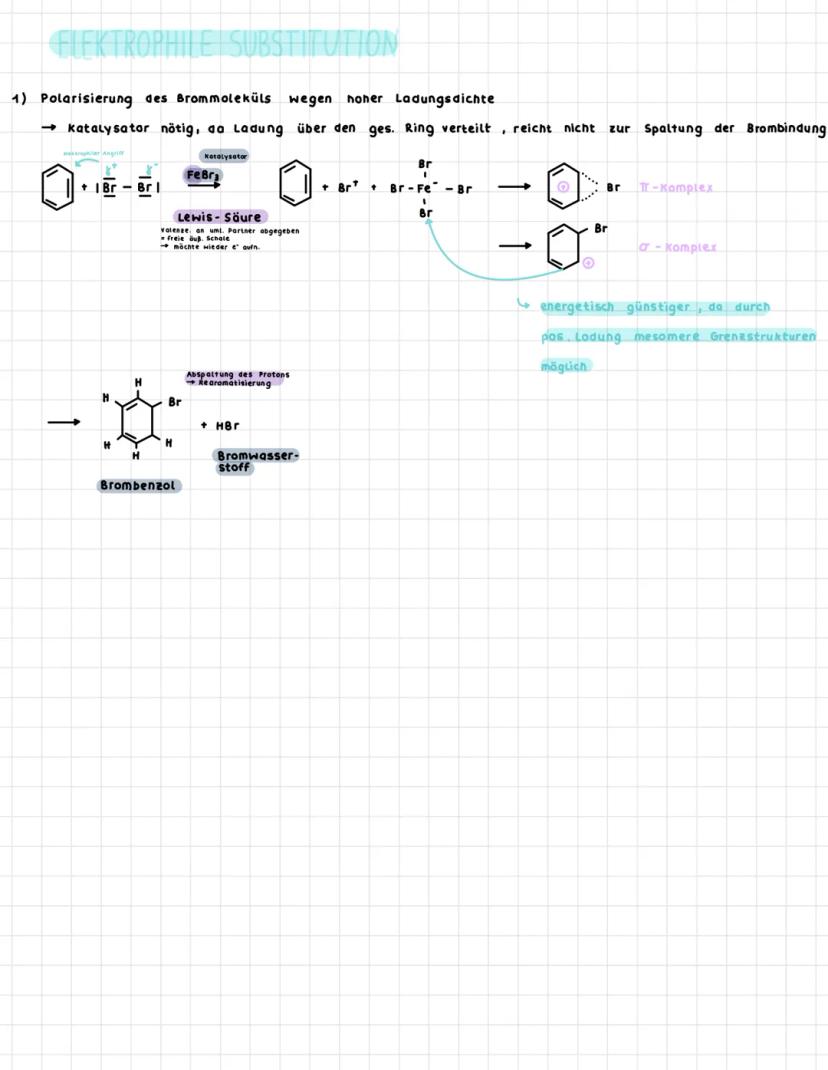
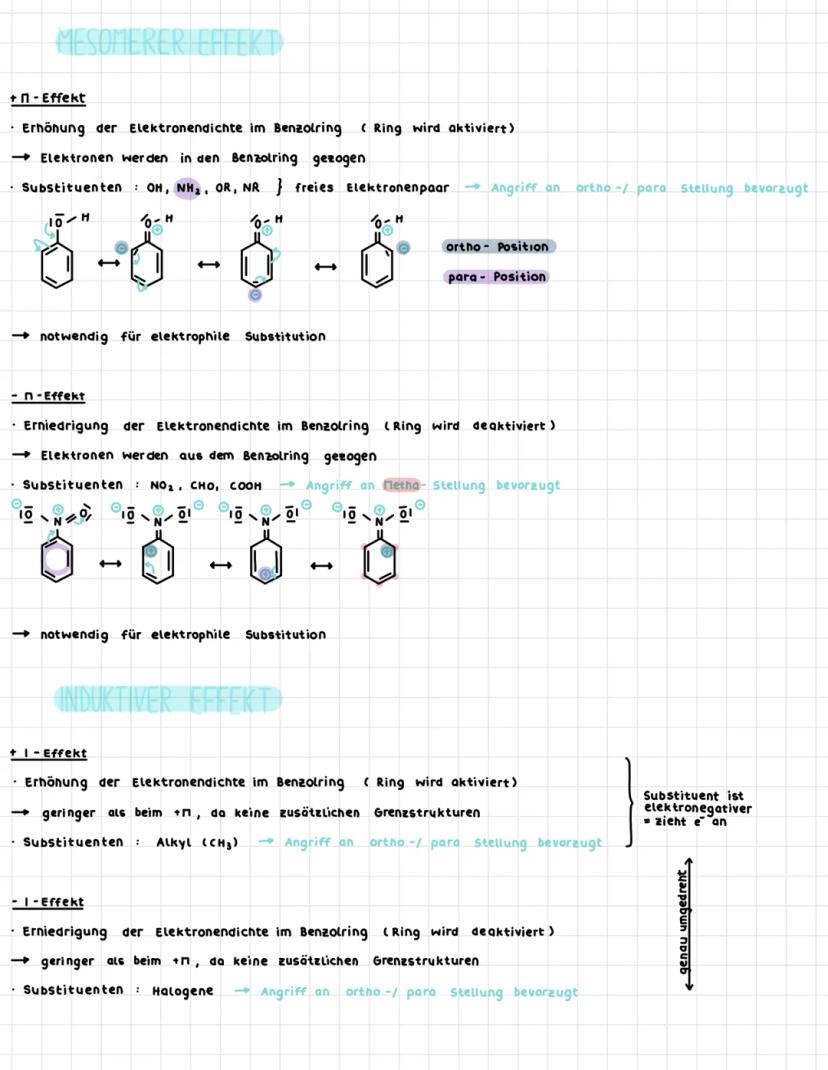
Mesomerer und Induktiver Effekt
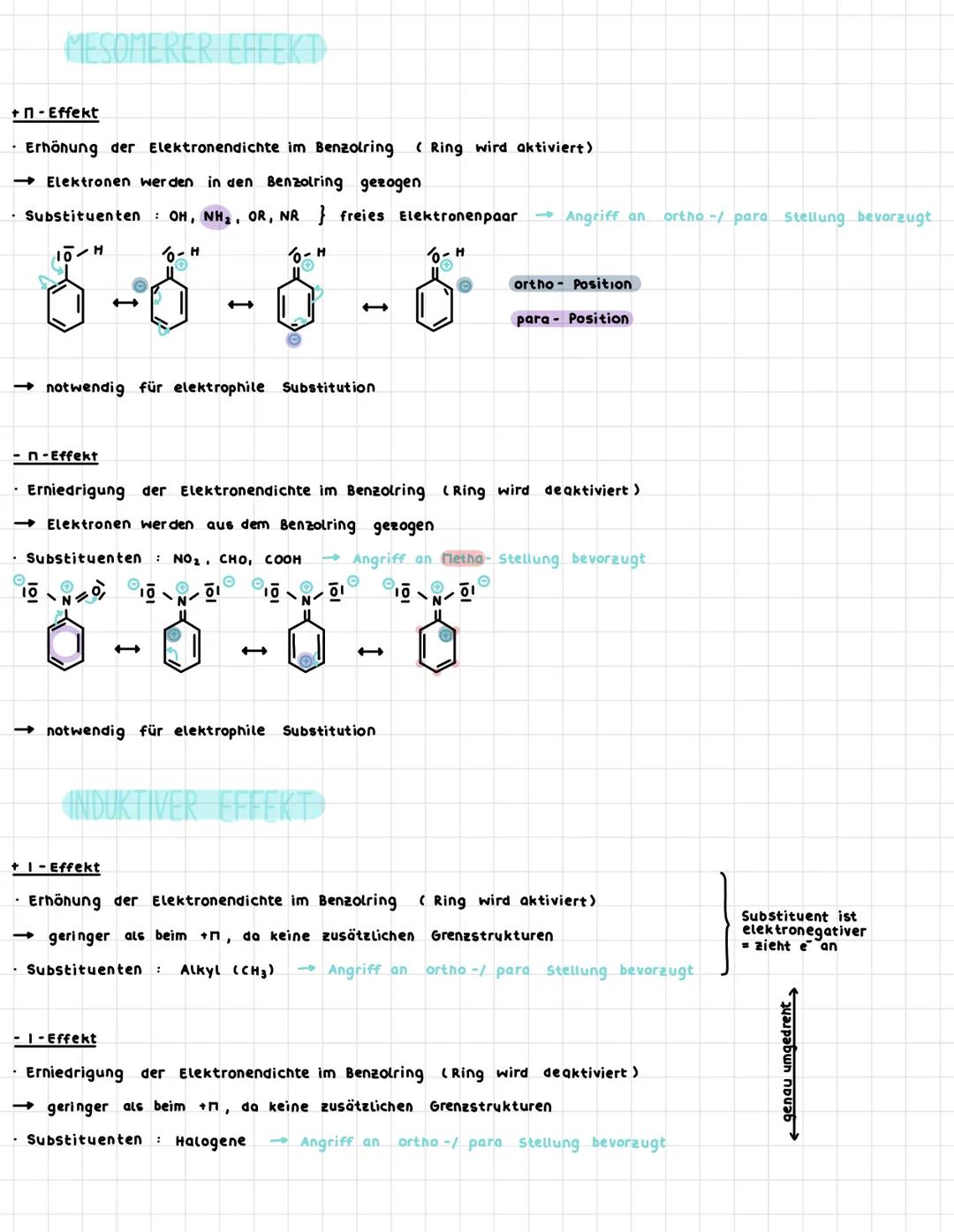
Mesomere Effekte entstehen durch freie Elektronenpaare oder π-Elektronen, die mit dem Benzolring wechselwirken. Der +π-Effekt erhöht die Elektronendichte im Ring und aktiviert ihn für elektrophile Substitution.
Substituenten wie OH, NH₂ oder OR haben freie Elektronenpaare, die in den Ring "geschoben" werden können. Dadurch wird besonders die ortho- und para-Position elektronenreich und für Elektrophile attraktiv.
Der -π-Effekt macht genau das Gegenteil: Substituenten wie NO₂, CHO oder COOH ziehen Elektronen aus dem Ring. Das deaktiviert ihn und macht die meta-Position am wenigsten ungünstig für Angriffe.
Induktive Effekte sind schwächer als mesomere, weil keine zusätzlichen Grenzstrukturen möglich sind. Alkylgruppen haben +I-Effekt (elektronenreich), Halogene haben -I-Effekt, dirigieren aber trotzdem nach ortho/para wegen ihrer freien Elektronenpaare.
💡 Faustregel: Mesomere Effekte schlagen induktive - deshalb dirigieren Halogene trotz -I-Effekt nach ortho/para!