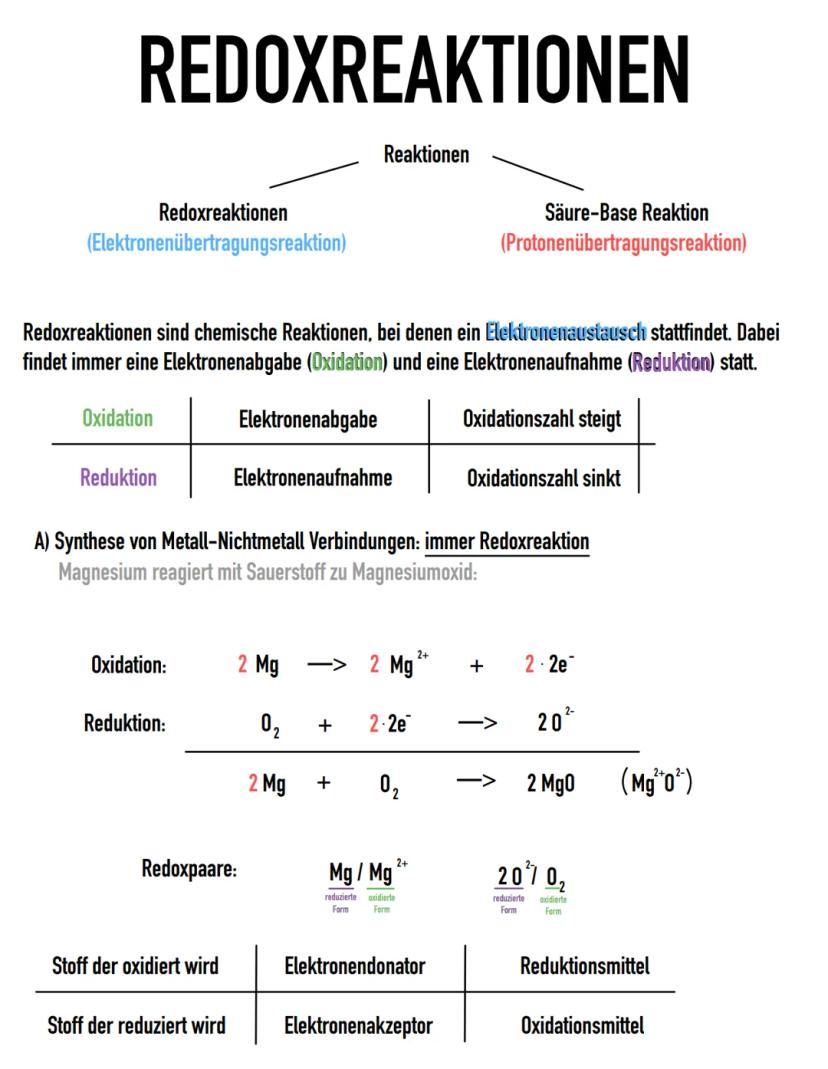
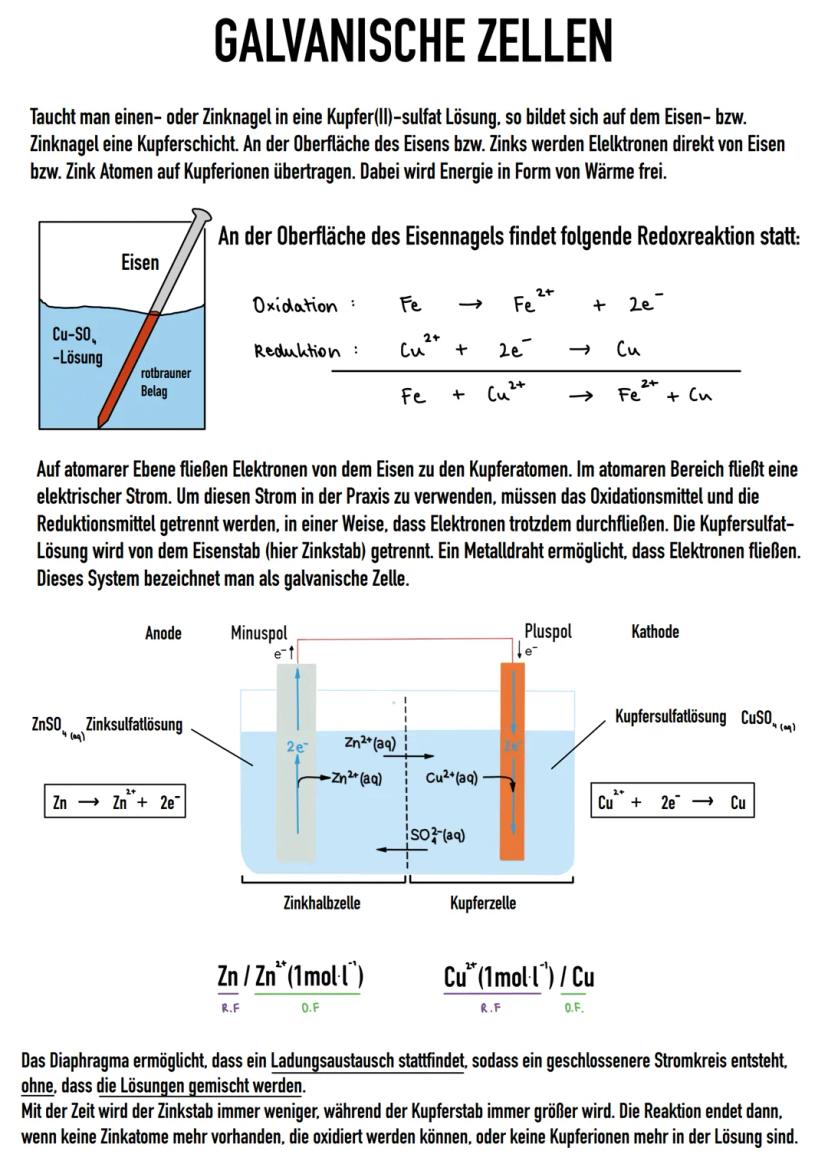
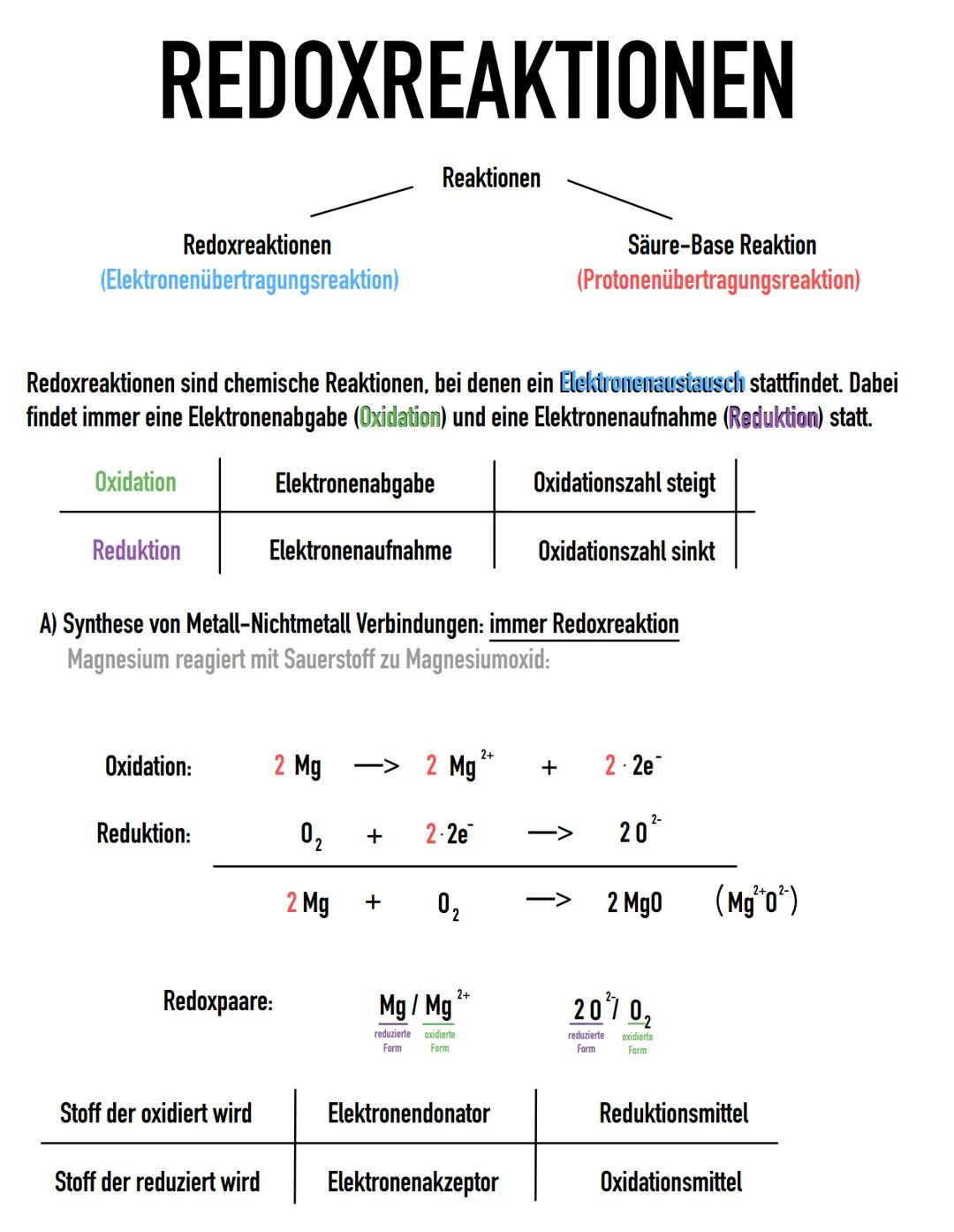
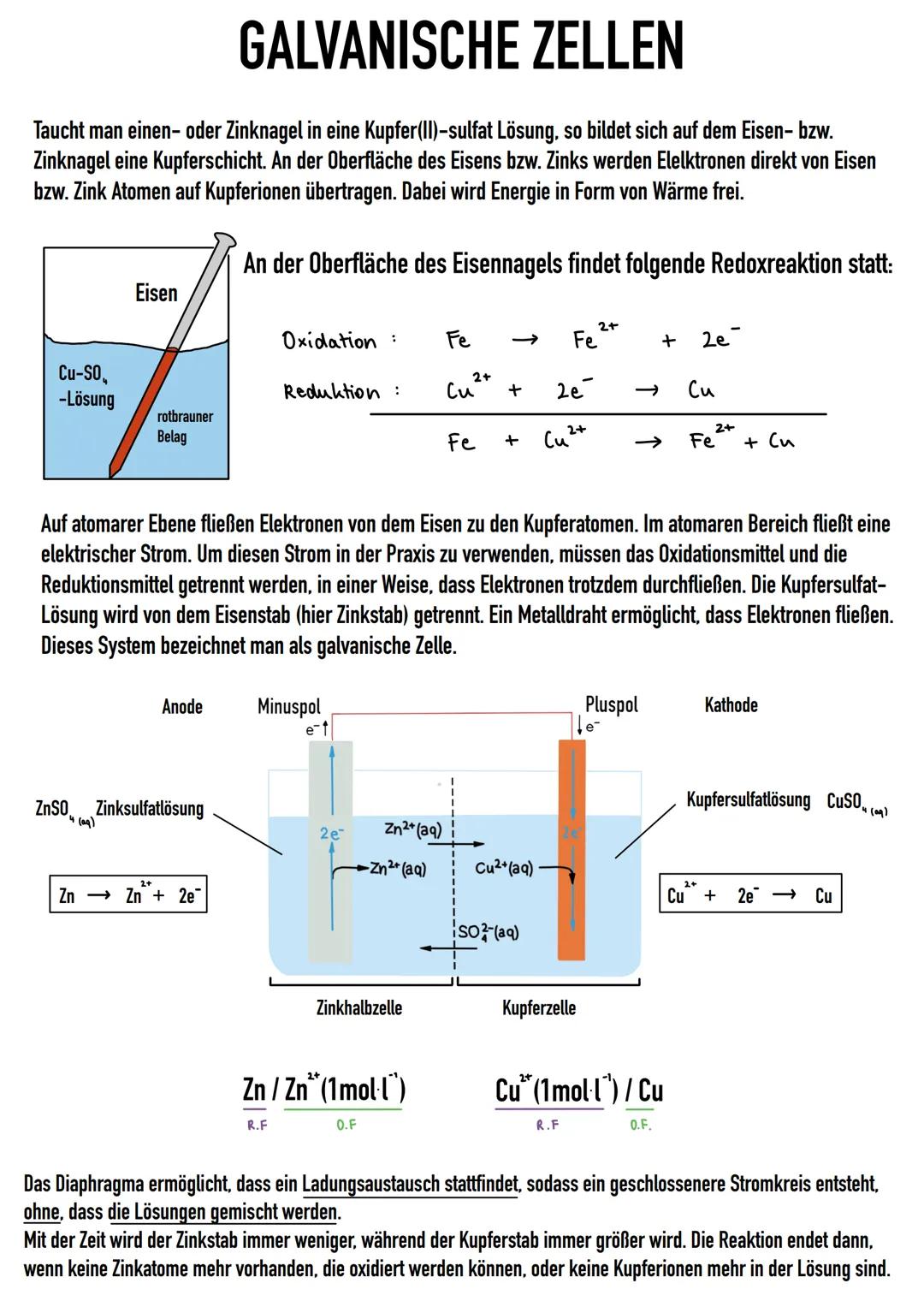
Die elektrochemische Spannungsreihe
Mit der elektrochemischen Spannungsreihe kannst du vorhersagen, welche Spannung eine galvanische Zelle liefert! Die Einzelpotentiale lassen sich nicht messen, aber ihre Differenz schon.
Die Standard-Wasserstoffelektrode dient als Bezugspunkt mit 0,00 V. Alle anderen Standardelektrodenpotentiale werden gegen diese gemessen. Zink hat -0,76 V, Kupfer +0,34 V und Silber +0,80 V.
Die Formel U = U₀(Kathode) - U₀(Anode) gibt dir direkt die Spannung. Für eine Zink-Kupfer-Zelle rechnest du: 0,34 V - −0,76V = 1,10 V. Je größer der Unterschied der Potentiale, desto höher die Spannung!
Prüfungstipp: Lerne die wichtigsten Standardpotentiale auswendig - sie kommen in fast jeder Klausur vor!