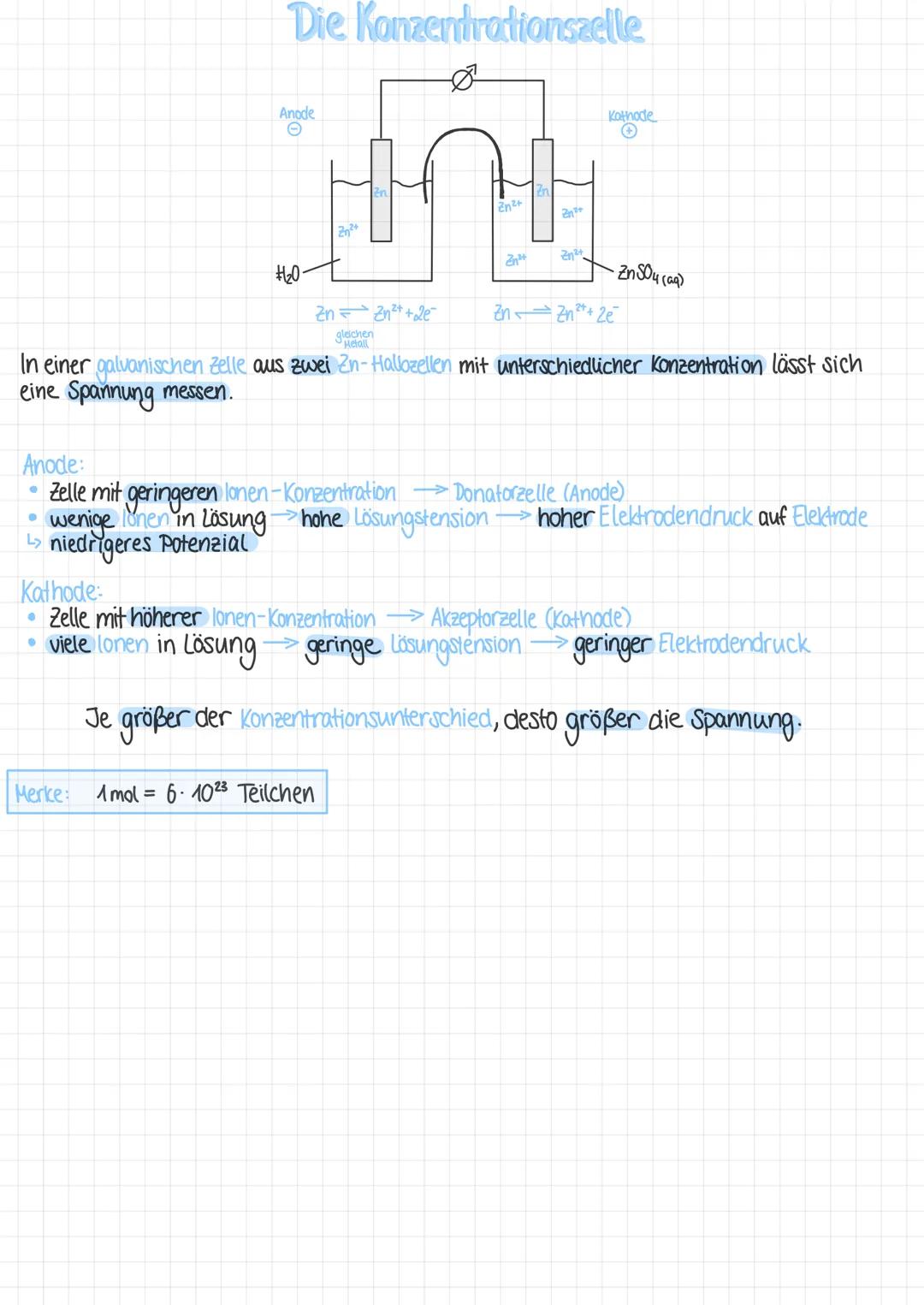
Die elektrochemische Spannungsreihe
Die elektrochemische Spannungsreihe ordnet Halbelemente nach ihren Standardpotentialen an. Das Vorzeichen verrät uns, ob ein Halbelement gegenüber der Standard-Wasserstoff-Halbzelle den Minus- oder Pluspol darstellt. Diese Spannungsreihe ist mit der Redoxreihe identisch.
Je negativer das Standardelektrodenpotential ist, desto stärker ist das Reduktionsmittel – es gibt also leichter Elektronen ab. Je positiver das Potential, desto stärker ist das Oxidationsmittel – es nimmt also leichter Elektronen auf.
🔑 Die Spannung einer galvanischen Zelle berechnet sich einfach durch Subtraktion: Uzelle = E°(Akzeptorzelle) - E°(Donatorhalbzelle). Diese Formel brauchst du für alle Berechnungen!
Die Berechnung der Zellspannung funktioniert durch Subtraktion der Standardpotentiale. Beim Daniell-Element beträgt die Spannung beispielsweise 1,1 V, berechnet aus dem Potential der Kupferzelle (0,337 V) minus dem Potential der Zinkzelle −0,763V. Kationen sind übrigens positiv geladene Ionen, Anionen negativ geladene Ionen – diese Teilchen werden bei Redoxreaktionen übertragen.