Indikatoren und ihre Anwendung
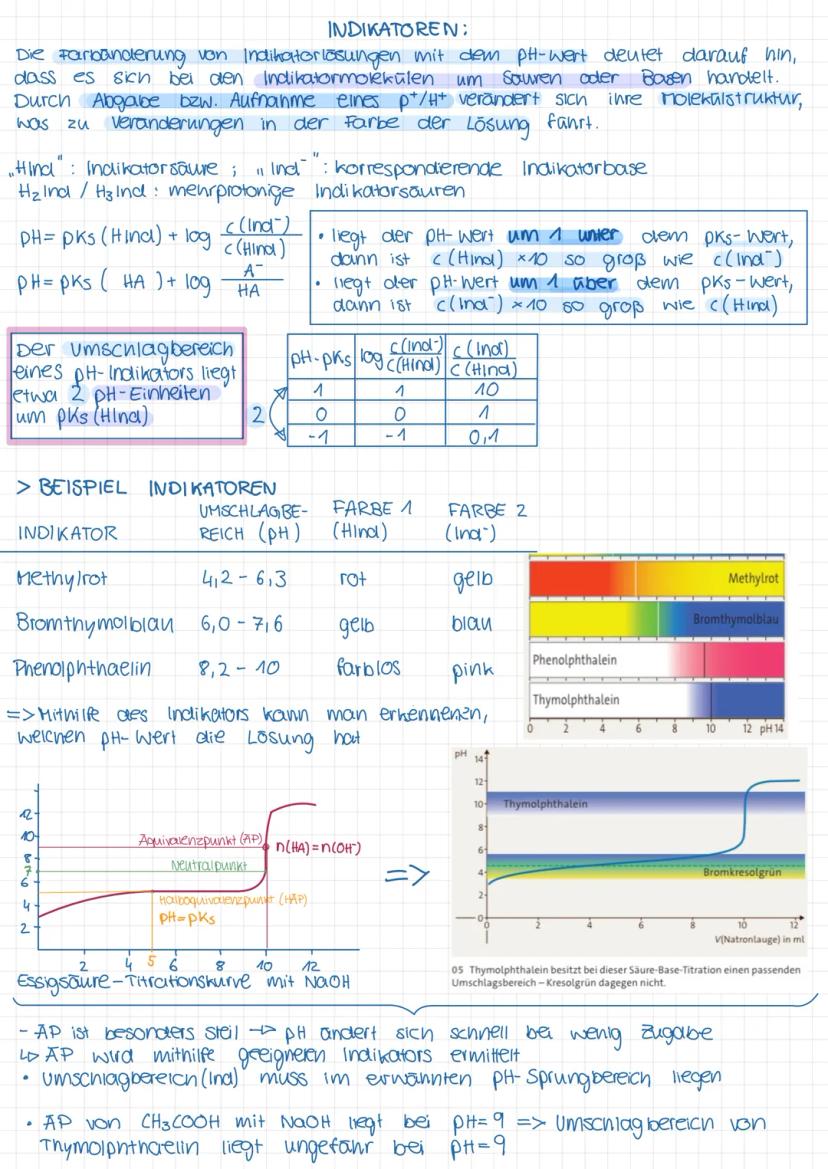
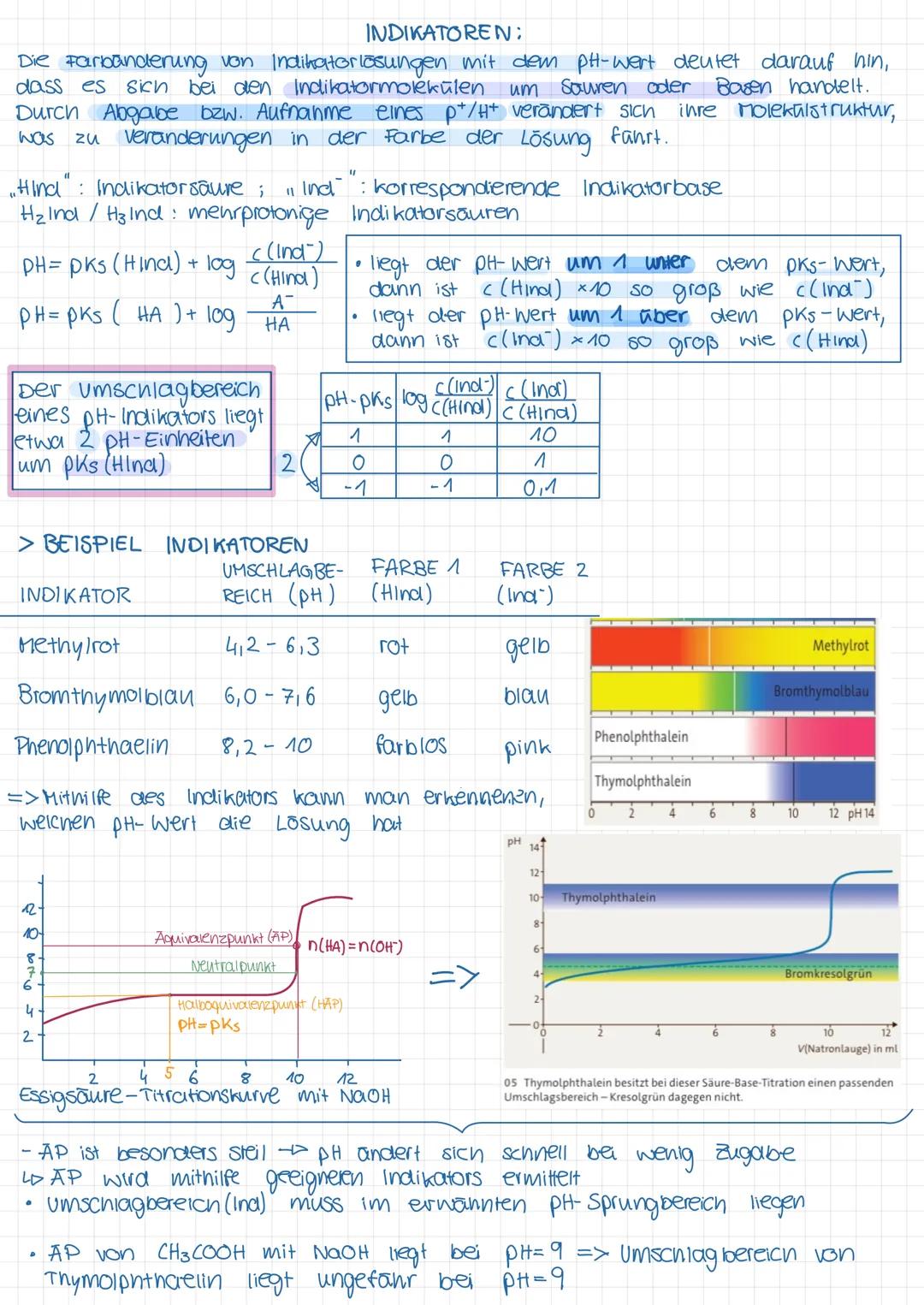
Indikatoren sind selbst schwache Säuren oder Basen, deren Molekülstruktur sich durch Abgabe oder Aufnahme eines Protons verändert, was zu einem Farbwechsel führt. Die Indikatorsäure (HInd) und ihre korrespondierende Base (Ind⁻) haben unterschiedliche Farben.
Der Farbumschlag eines Indikators erfolgt in einem bestimmten pH-Bereich, der etwa 2 pH-Einheiten um den pKₛ-Wert des Indikators liegt. Der pH-Wert kann mit der Formel pH = pKₛ(HInd) + logc(Ind−)/c(HInd) berechnet werden.
Für Säure-Base-Titrationen ist die Wahl des richtigen Indikators entscheidend. Der Umschlagsbereich muss im pH-Sprungbereich des Äquivalenzpunkts liegen. Beispielsweise eignet sich Phenolphthalein Umschlagsbereich8,2−10,0 gut für die Titration von Essigsäure mit Natronlauge, da der Äquivalenzpunkt bei etwa pH 9 liegt.
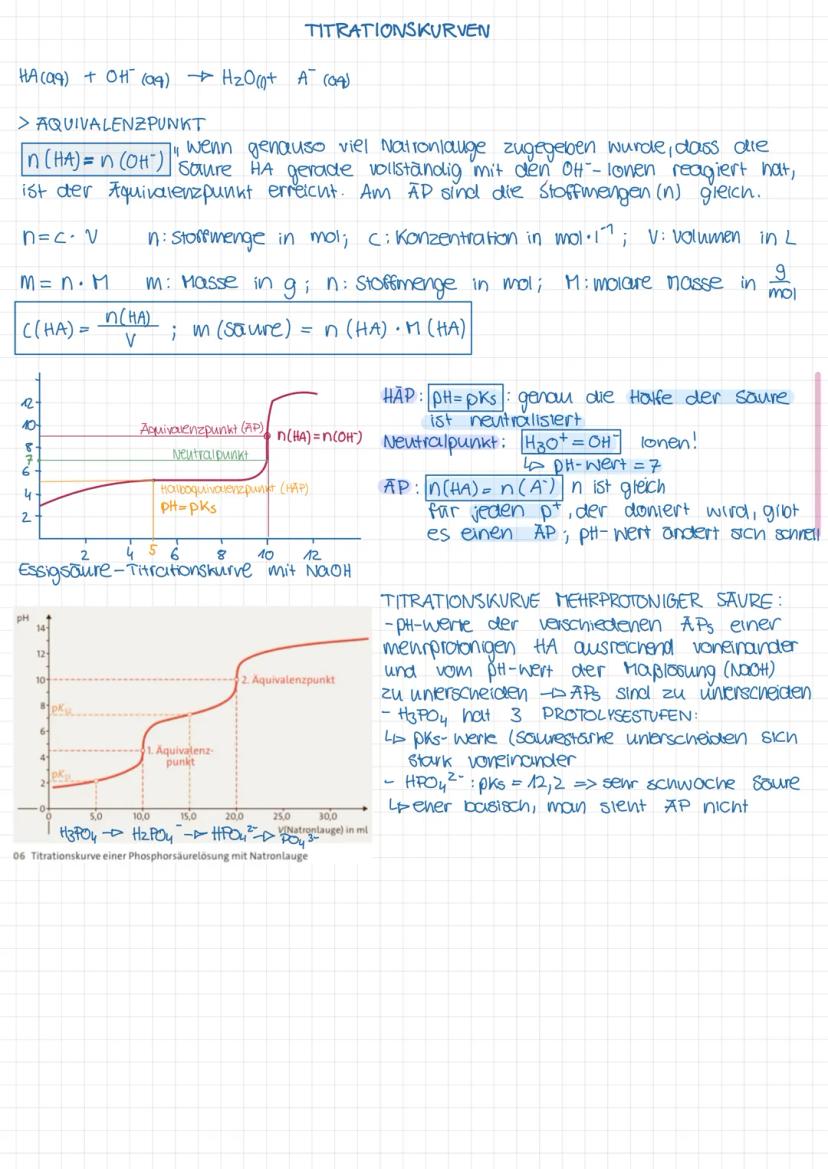
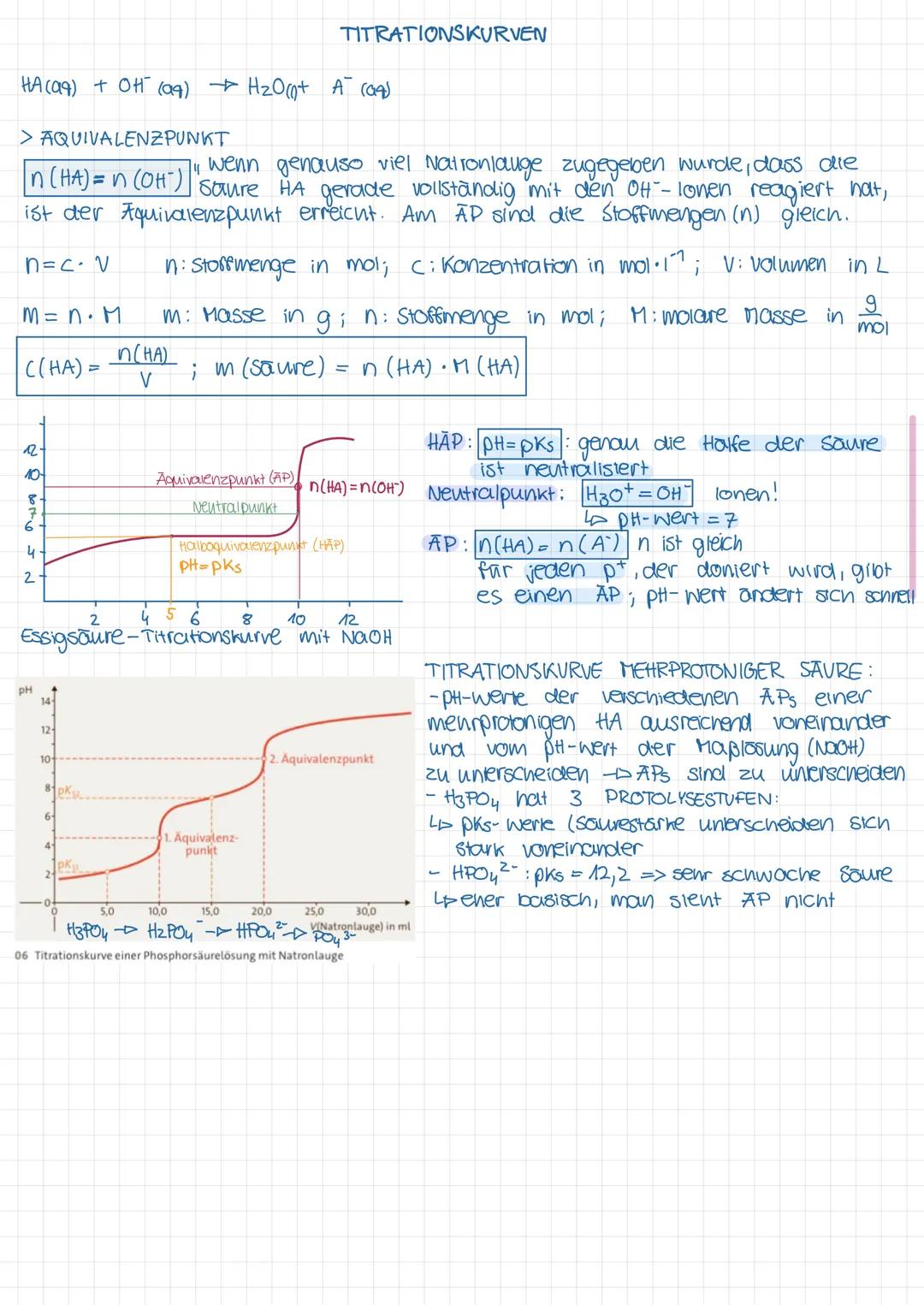
📝 Beim Äquivalenzpunkt einer Titration sind die Stoffmengen der Säure und Base gleich n(HA)=n(OH−). Die Titrationskurve zeigt hier einen steilen Anstieg, was bedeutet, dass sich der pH-Wert bei geringer Zugabe stark ändert – genau hier muss der Indikator umschlagen!