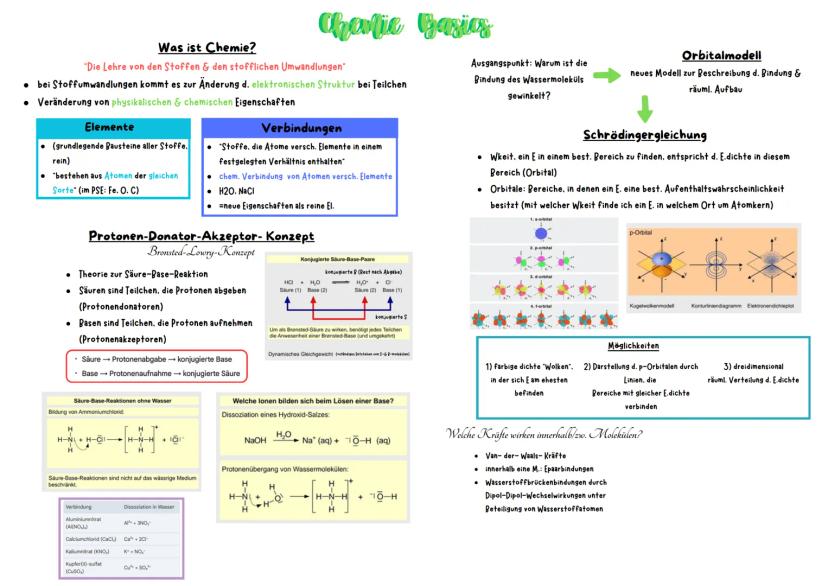
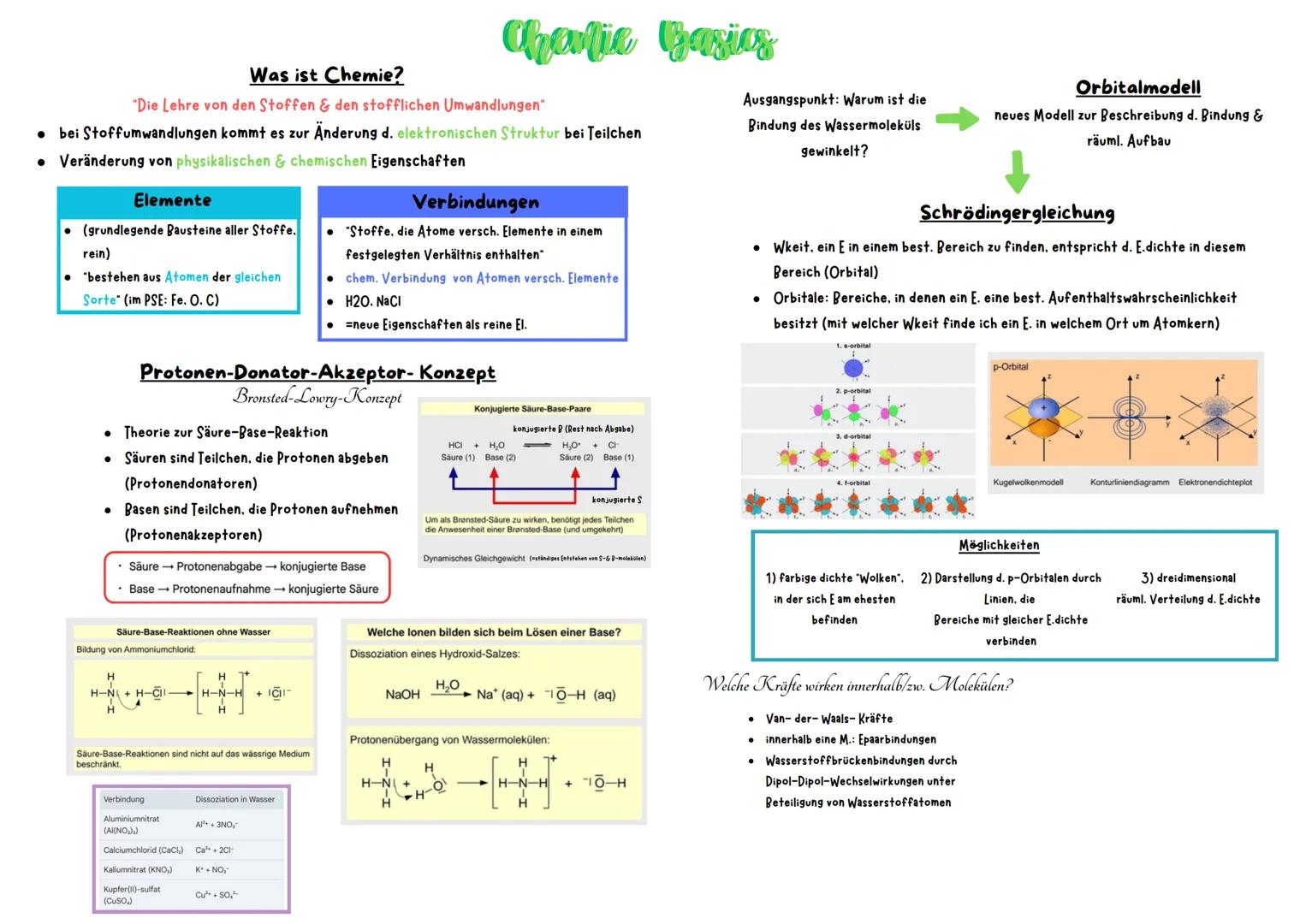
Redoxreaktionen & molare Berechnungen
Redoxreaktionen sind im Grunde ein Elektronentausch zwischen Stoffen - ein Stoff gibt Elektronen ab (Oxidation), der andere nimmt sie auf (Reduktion). Das klassische Beispiel ist Rostbildung, wo Eisen Elektronen an Sauerstoff abgibt.
Die elektrochemische Spannungsreihe zeigt euch, welche Elemente gerne Elektronen abgeben oder aufnehmen. Positive Werte bedeuten leichte Elektronenaufnahme, negative Werte bedeuten leichte Elektronenabgabe. Unedle Metalle wie Zink geben dabei gerne Elektronen an edle Metalle wie Kupfer ab.
Für molare Berechnungen braucht ihr die Formel n = m/M Stoffmenge=Masse/molareMasse. Die molare Masse ist einfach die Atommasse in g/mol. Bei Redoxreaktionen müsst ihr zuerst die Teilgleichungen aufstellen, dann die Elektronen ausgleichen und schließlich alles zusammenfassen.
Merktipp: OIL RIG - Oxidation Is Loss (of electrons), Reduction Is Gain (of electrons)
Bei Konzentrationsangaben unterscheidet ihr zwischen Massenkonzentration, Volumenkonzentration und Stoffmengenkonzentration. Die Stoffmengenkonzentration c = n/V ist besonders wichtig für Reaktionsberechnungen.