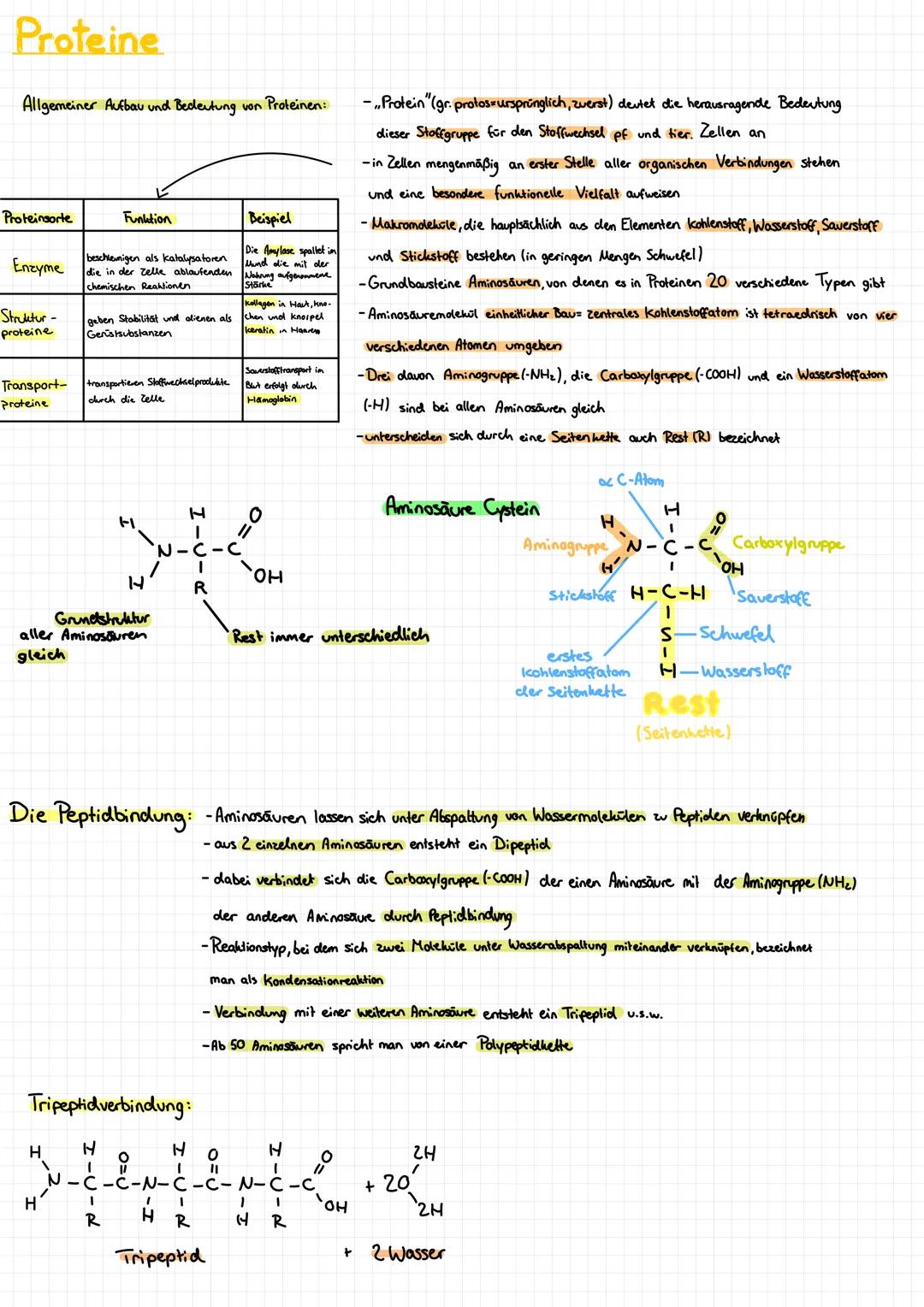
Proteinstruktur - Vom eindimensionalen Faden zum 3D-Meisterwerk
Eine einfache Polypeptidkette ist noch kein funktionsfähiges Protein – erst durch die richtige räumliche Faltung wird es arbeitsfähig. Dabei durchläuft es vier Strukturebenen, die aufeinander aufbauen.
Die Primärstruktur ist wie ein Rezept: Sie gibt die exakte Reihenfolge der Aminosäuren vor. Diese Aminosäuresequenz ist für jedes Protein einzigartig und bestimmt alle seine Eigenschaften. Bei der Sekundärstruktur faltet sich die Kette in charakteristische Formen: spiralförmige α-Helices (wie eine Wendeltreppe) oder gefaltete β-Faltblätter (wie eine Ziehharmonika). Wasserstoffbrücken zwischen den Peptidbindungen halten diese Strukturen stabil.
Die Tertiärstruktur bringt das Protein in seine endgültige 3D-Form. Verschiedene chemische Bindungen zwischen den Seitenketten – Wasserstoffbrücken, Ionenbindungen, hydrophobe Wechselwirkungen und starke Disulfidbrücken – sorgen für die perfekte Gestalt.
Manche Proteine haben sogar eine Quartärstruktur: Mehrere Polypeptidketten arbeiten als Team zusammen, wie beim Hämoglobin mit seinen vier Untereinheiten. Dadurch entstehen völlig neue Fähigkeiten, die eine einzelne Kette nie haben könnte.
Wichtig: Schon eine falsche Aminosäure in der Primärstruktur kann das ganze Protein funktionsunfähig machen – wie ein Tippfehler, der den ganzen Sinn verändert!