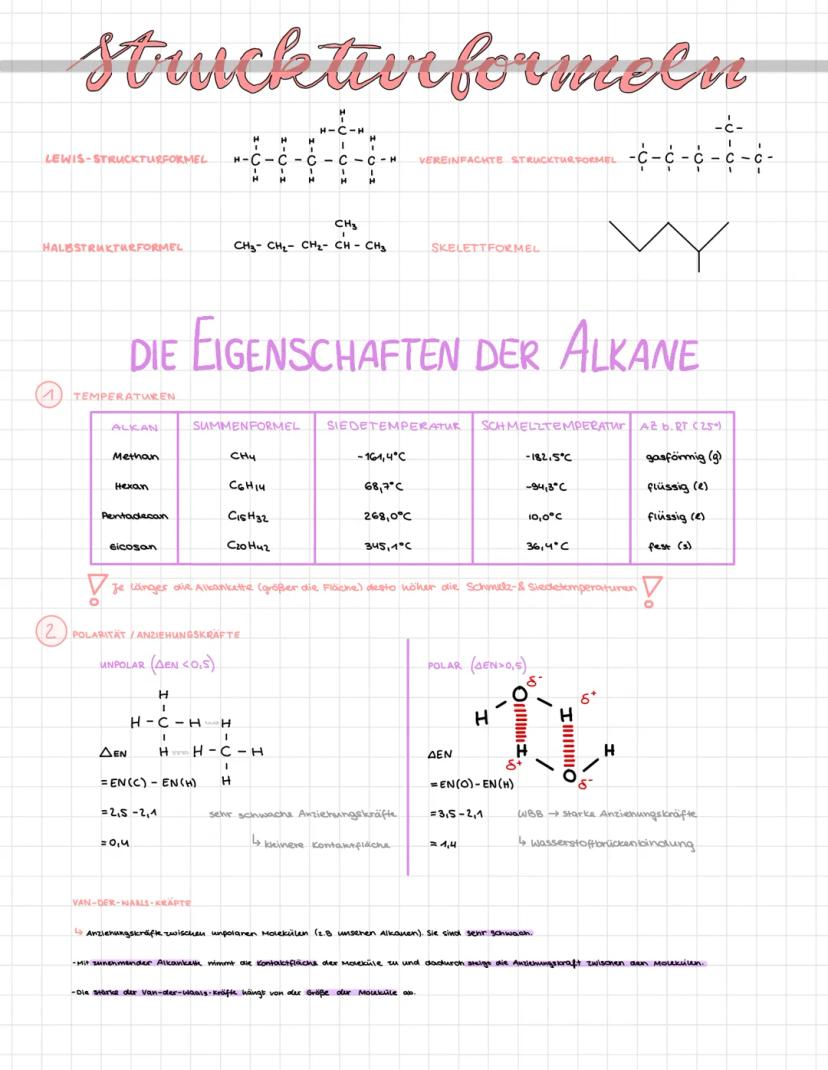
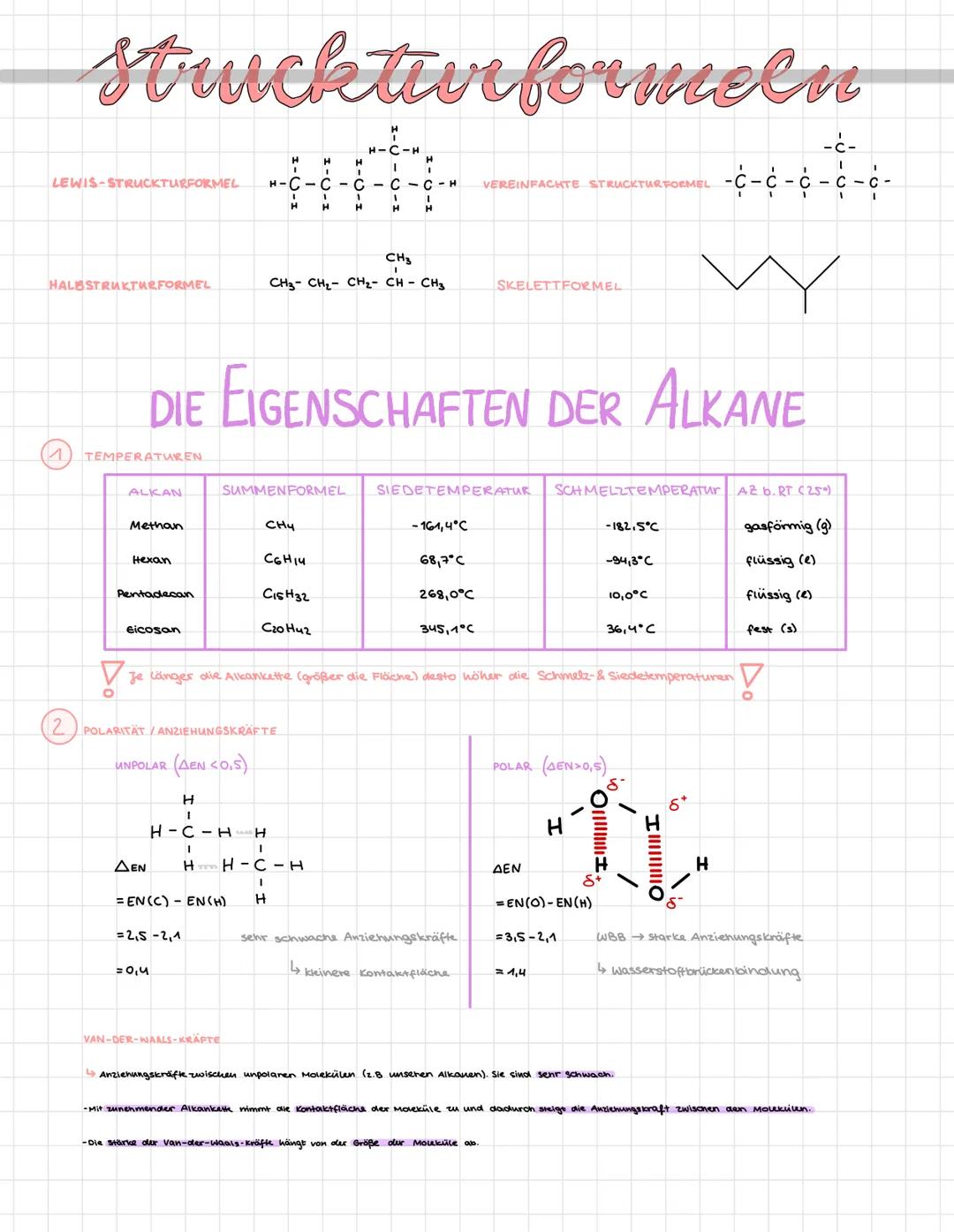
Strukturformeln und Eigenschaften der Alkane
Alkane können auf verschiedene Arten dargestellt werden: als Lewis-Strukturformel, vereinfachte Strukturformel, Halbstrukturformel oder Skelettformel. Jede Darstellungsform hat ihre Vorteile, je nachdem welche Aspekte du betonen möchtest.
Die Siedetemperatur der Alkane steigt mit der Kettenlänge. Während Methan (CH₄) bei -161,4°C siedet und bei Raumtemperatur gasförmig ist, ist Eicosan (C₂₀H₄₂) mit einem Siedepunkt von 345,1°C bei Raumtemperatur fest. Der Grund: Längere Ketten haben größere Moleküloberflächen und damit stärkere van-der-Waals-Kräfte.
Alkane sind unpolar, da die Elektronegativitätsdifferenz zwischen Kohlenstoff und Wasserstoff nur 0,4 beträgt (ΔEN<0,5). Die Anziehungskräfte zwischen Alkanmolekülen sind daher sehr schwach. Im Gegensatz dazu haben polare Moleküle wie Wasser starke Wasserstoffbrückenbindungen, weil die Elektronegativitätsdifferenz zwischen Sauerstoff und Wasserstoff 1,4 beträgt.
💡 Wichtig: Van-der-Waals-Kräfte sind schwache Anziehungskräfte zwischen unpolaren Molekülen. Je größer die Kontaktfläche zwischen den Molekülen, desto stärker sind diese Kräfte!