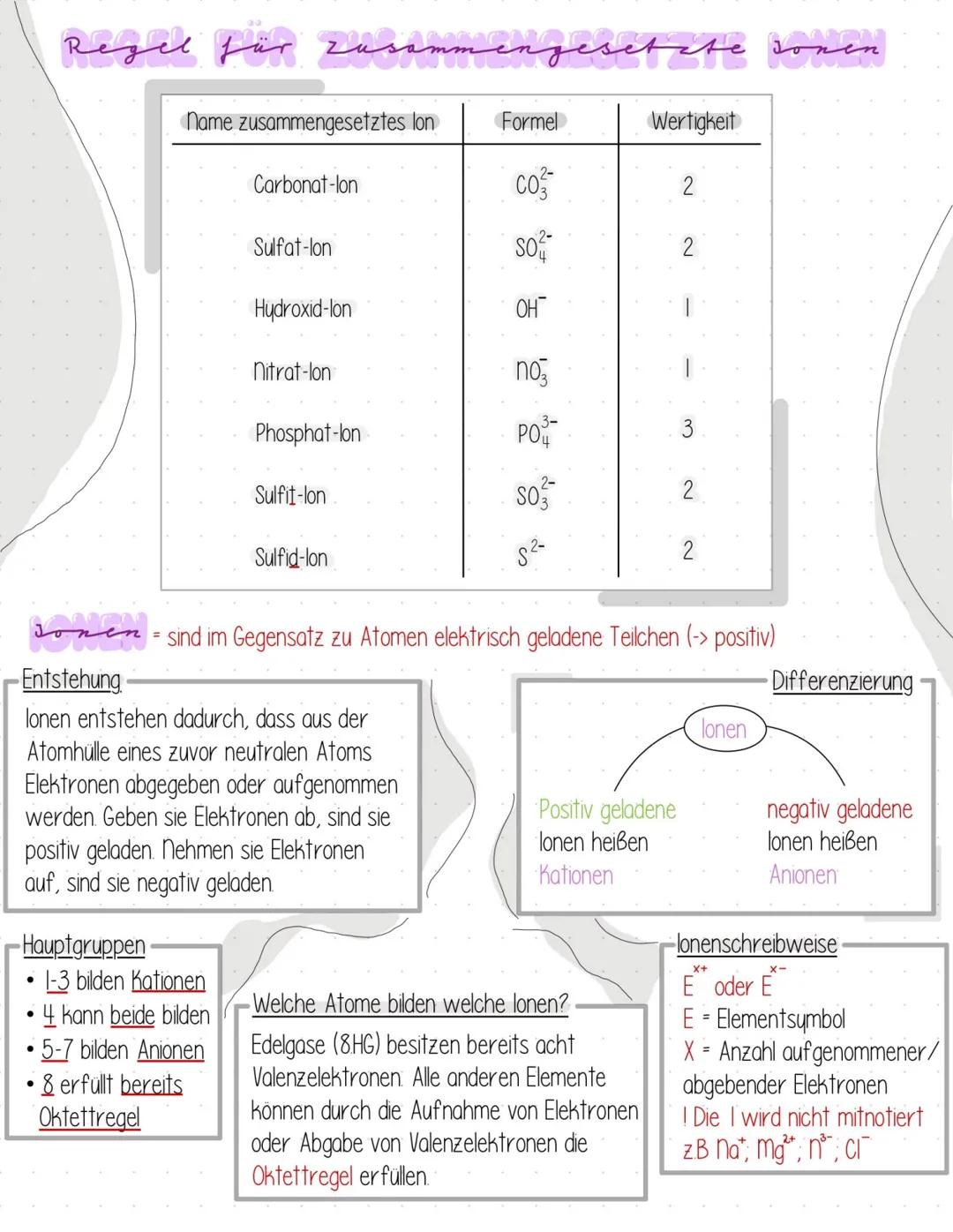
Ionen - Die Grundlagen
Ionen sind elektrisch geladene Teilchen, die sich von normalen Atomen dadurch unterscheiden, dass sie Elektronen gewonnen oder verloren haben. Wenn ein Atom Elektronen abgibt, wird es positiv geladen - nimmt es welche auf, wird es negativ.
Die Entstehung ist eigentlich ganz logisch: Atome wollen stabil werden und streben die Oktettregel an (acht Elektronen in der äußeren Schale). Edelgase haben das schon von Natur aus, alle anderen müssen sich anstrengen.
Kationen sind positiv geladene Ionen, Anionen sind negativ geladen. Die Hauptgruppen 1-3 bilden meist Kationen, die Gruppen 5-7 werden zu Anionen. Gruppe 4 kann beides, je nach Situation.
Merktipp: Kationen sind positiv (haben Elektronen weggegeben), Anionen sind negativ (haben Elektronen angenommen).
Bei der Ionenschreibweise schreibst du das Elementsymbol mit der Ladung als Hochzahl: Na⁺, Cl⁻, Mg²⁺. Bei einfacher Ladung lässt du die "1" weg.
Die Tabelle zeigt dir wichtige zusammengesetzte Ionen wie Carbonat (CO₃²⁻) oder Sulfat (SO₄²⁻) - diese Gruppen verhalten sich wie einzelne Ionen und haben feste Wertigkeiten, die du dir merken solltest.