Kinetik - Grundlagen und Definitionen
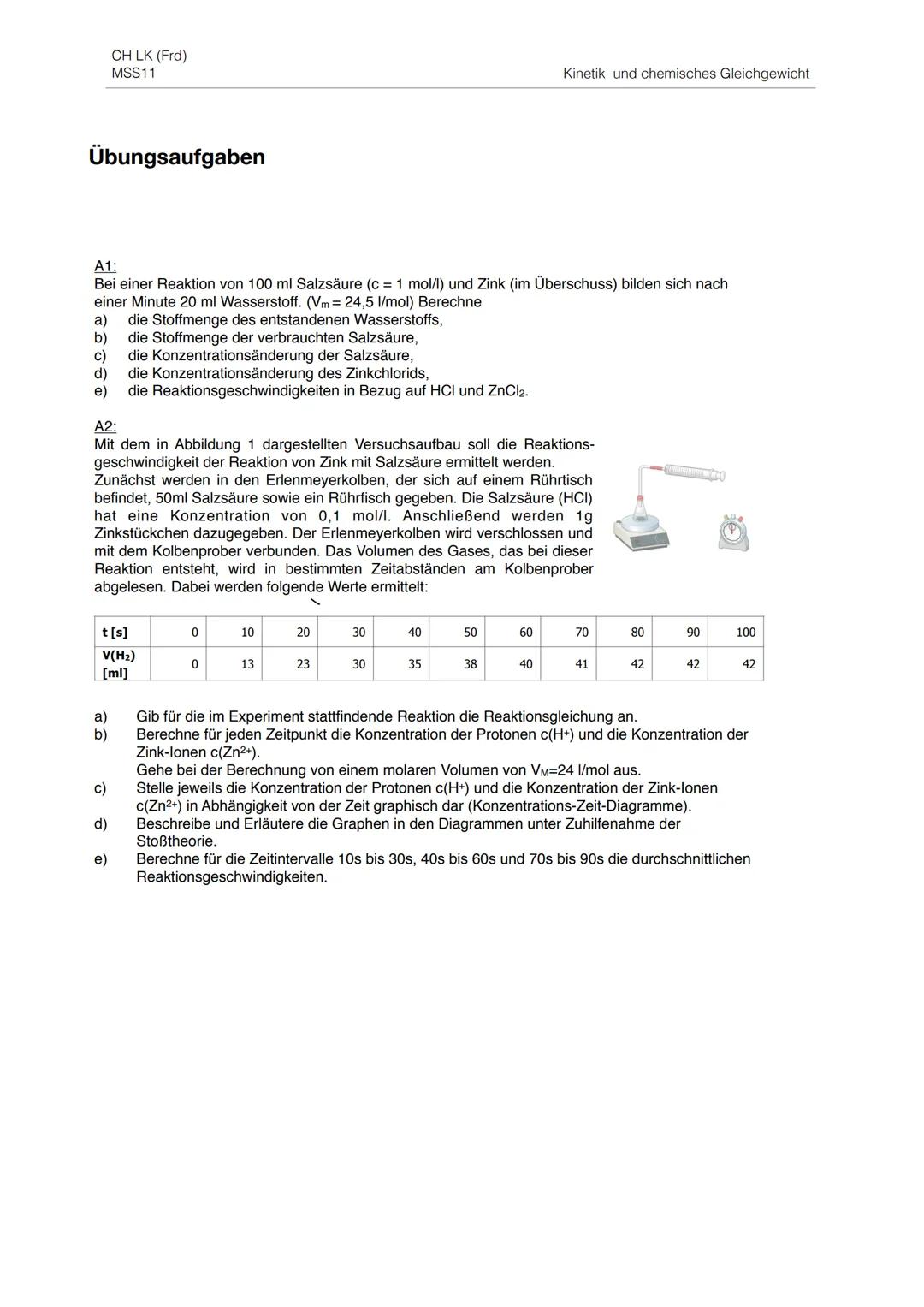
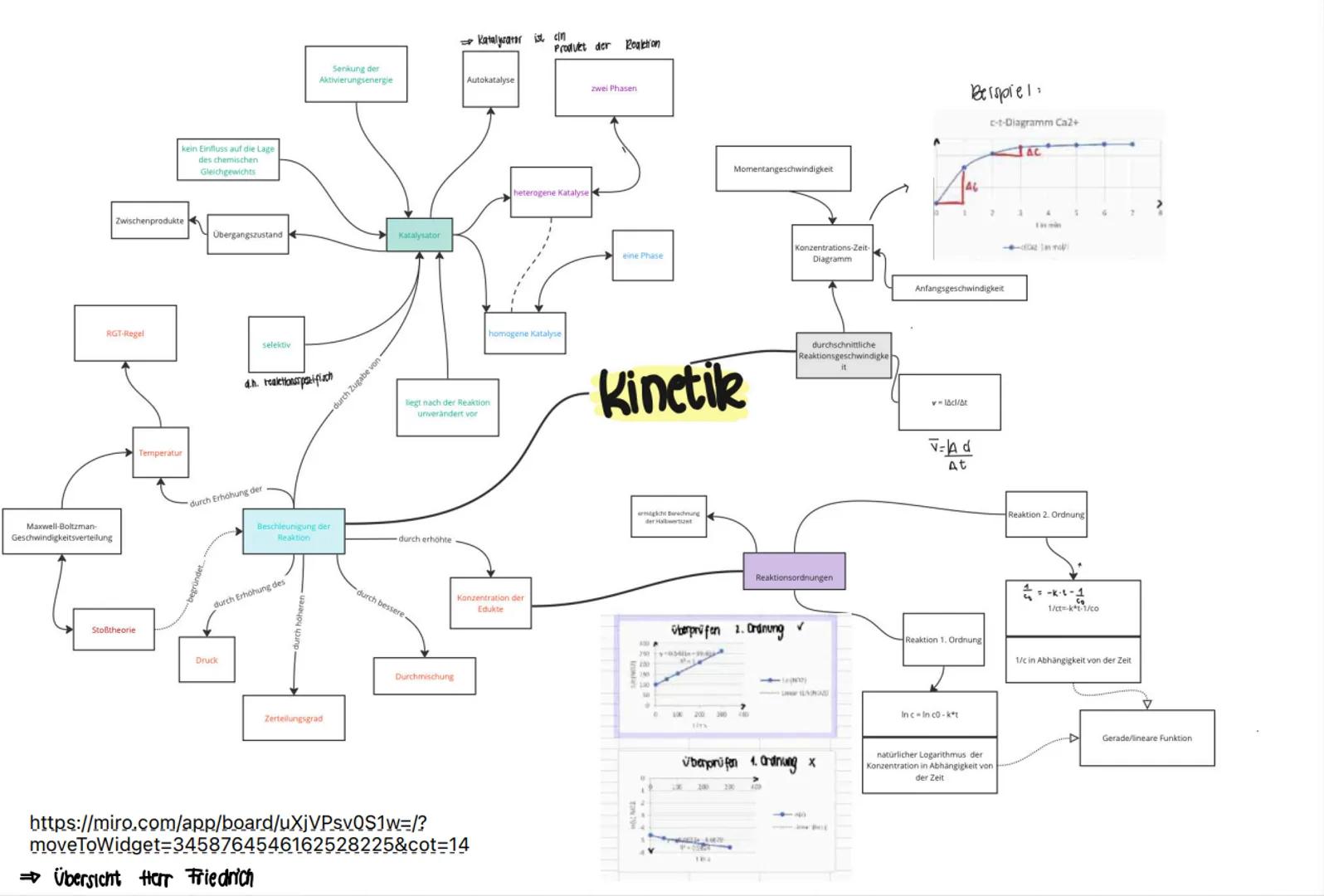
Die Reaktionsgeschwindigkeit zeigt dir, wie viele wirksame Zusammenstöße pro Zeiteinheit stattfinden. Du berechnest sie mit der Formel: RG = Δc/Δt.
Die Stoßtheorie erklärt, wann Teilchen erfolgreich reagieren: Sie brauchen die richtige räumliche Anordnung und die Mindestenergie Emin. Nur dann entstehen neue Bindungen.
Sechs Faktoren beeinflussen die Reaktionsgeschwindigkeit: Temperatur, Druck, Konzentration, Durchmischung, Zerteilungsgrad und Katalysatoren. Je höher diese Werte, desto schneller läuft die Reaktion ab.
Die Reaktionsordnung (erste oder zweite Ordnung) zeigt dir, von welchen Ausgangsstoffen die Geschwindigkeit abhängt. Das musst du aus Messwerten ermitteln können.
Merkhilfe: Höhere Temperatur = höhere kinetische Energie = mehr wirksame Stöße!