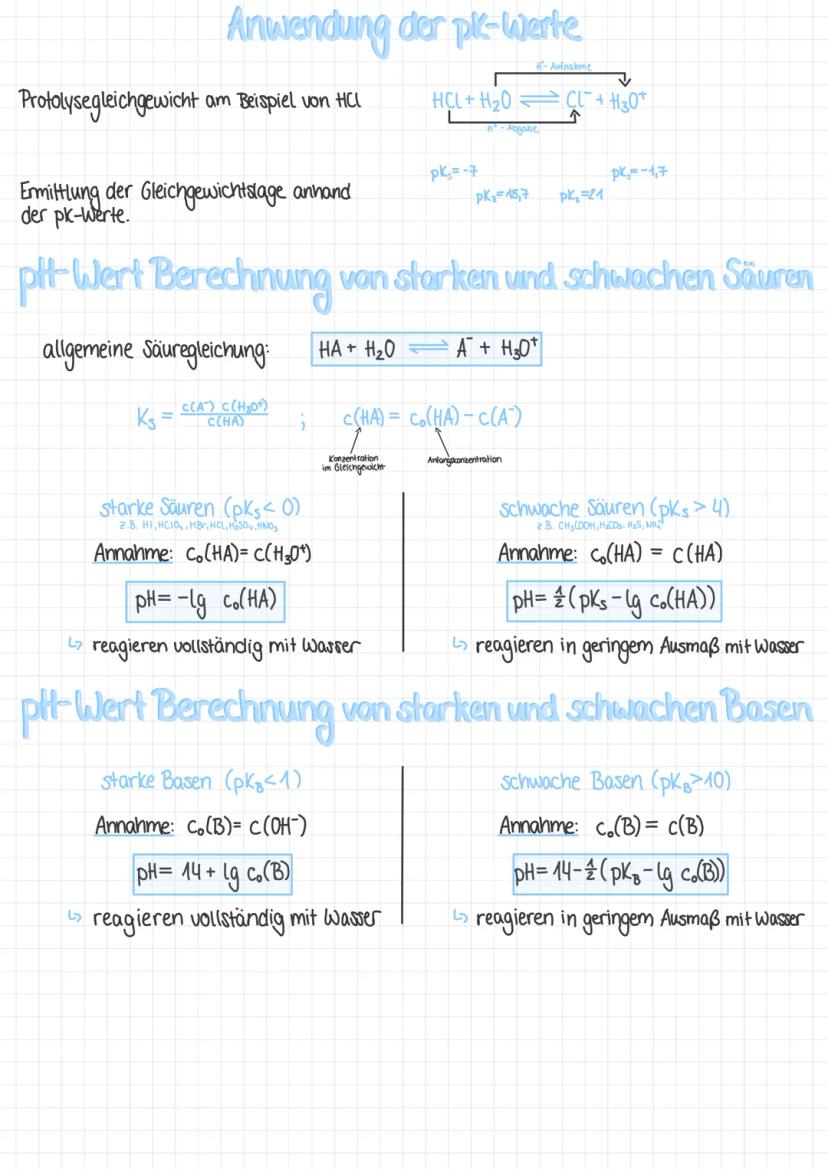
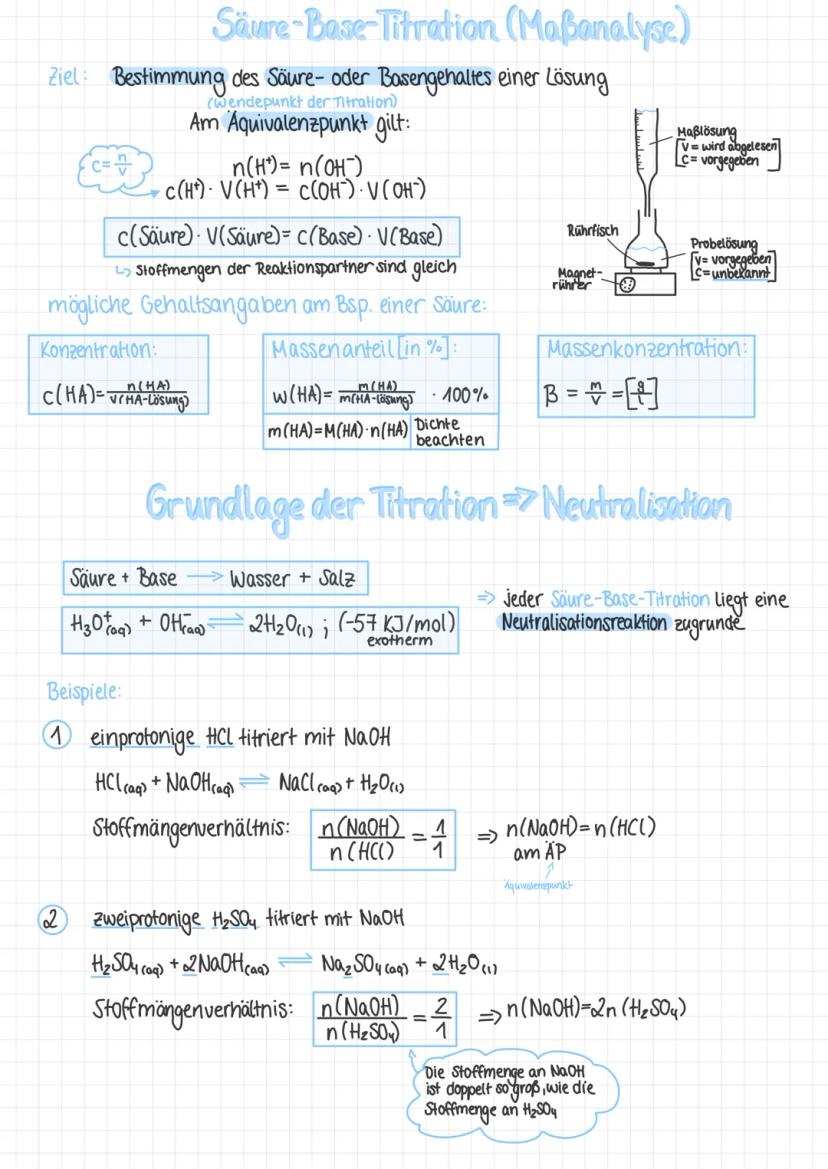
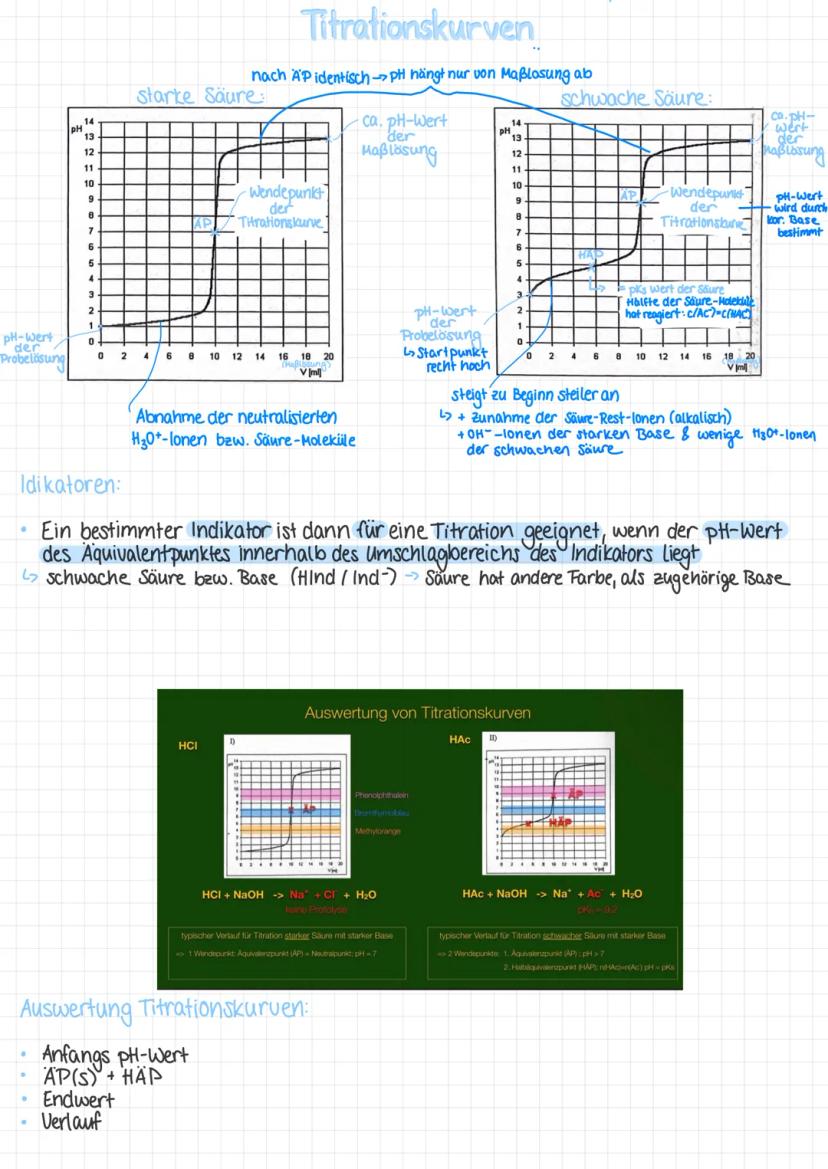
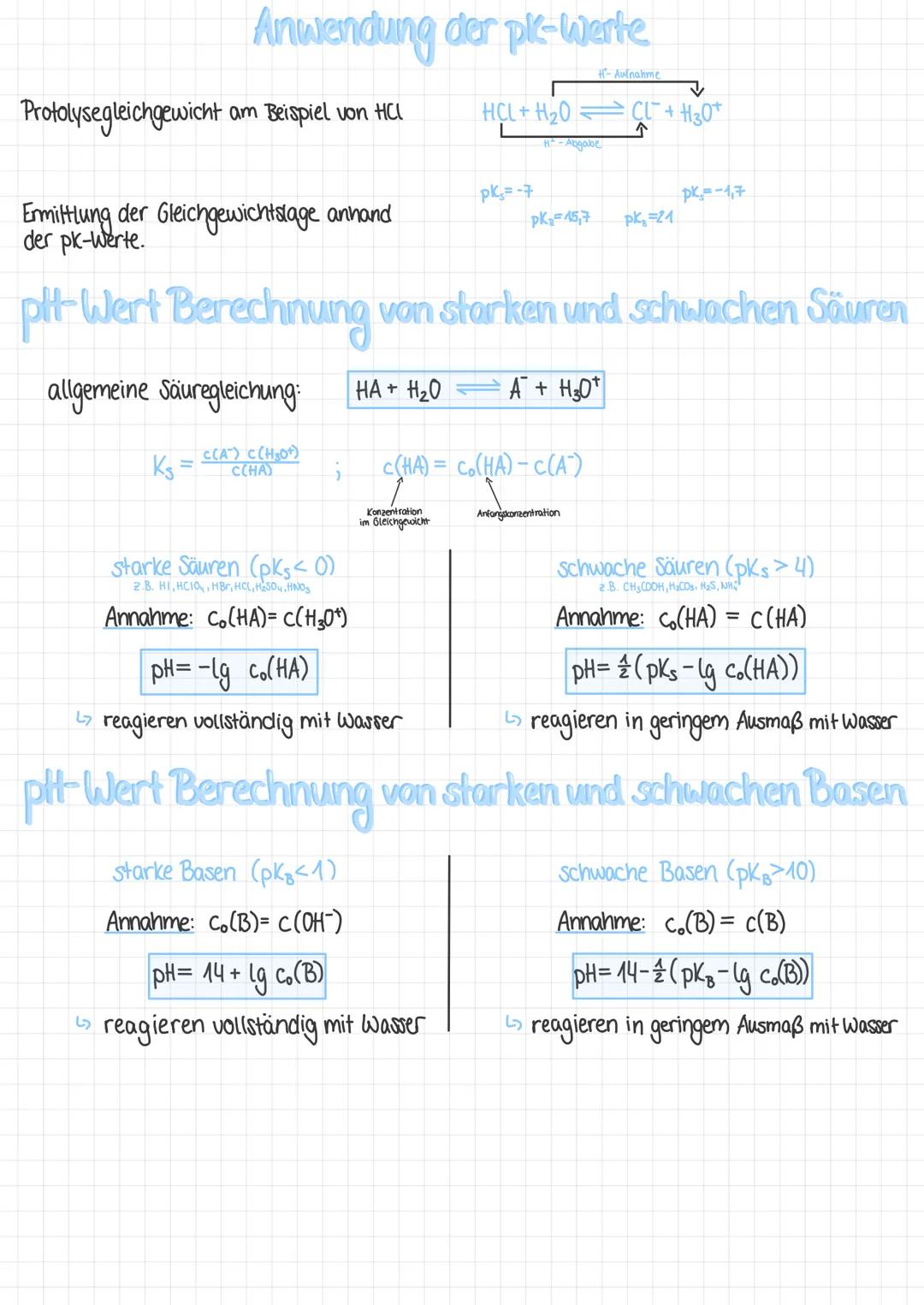
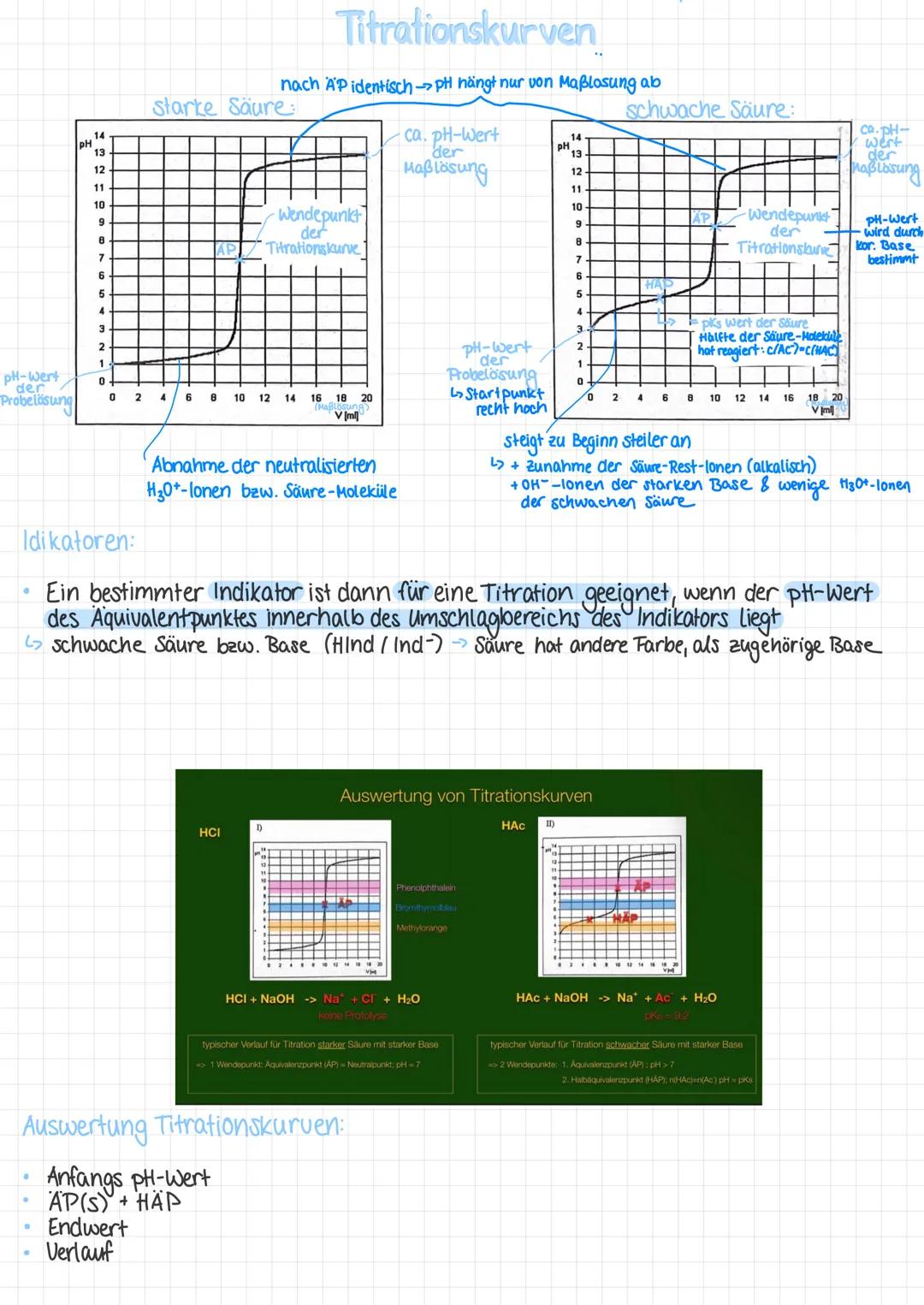
Titrationskurven berechnen - schwache Säuren
Die Titration schwacher Säuren ist komplexer! Start: Essigsäure pKs=4,8 ergibt pH = 2,9 bei c = 0,1 M.
Halbäquivalenzpunkt (HAP): Hier ist die Hälfte der Säure neutralisiert. Es gilt c(HAc) = c(Ac⁻), deshalb: pH = pKs = 4,8. Diese Henderson-Hasselbalch-Beziehung ist goldwert!
Äquivalenzpunkt: Jetzt bestimmt das entstandene Acetat-Ion den pH-Wert. Ac⁻ ist eine schwache Base pKB=9,2, daher pH > 7. Konkret: pH ≈ 8,8.
Achtung: Bei schwachen Säuren liegt der AP immer im basischen Bereich - vergiss das nicht bei der Indikator-Auswahl!